Bộ 20 đề thi học kì 1 Hóa 8 có đáp án
Bộ 20 đề thi học kì 1 Hóa 8 có đáp án (Đề 4)
-
881 lượt thi
-
23 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Tính chất nào của chất trong số các tính chất sau đây có thể biết được bằng cách quan sát trực tiếp mà không cần dụng cụ đo hay làm thí nghiệm:
 Xem đáp án
Xem đáp án
Đáp án A
Màu sắc có thể quan sát bằng mắt thường.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Tác được 2 chất trong hỗn hợp có: 1 chất tan trong nước, còn 1 chất thì không tan
Giải chi tiết:
Cát và muối hòa tan vào trong nước dư => lọc phần chất rắn không tan thu được cát
Dd nước muối thu được ta đem chưng cất để làm bay hơi hết nước đi => thu được muối khan
Do vậy tách riêng được cát và muối
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án B
C có 6+ e hạt nhân => lớp vỏ ngoài cùng có 4 electron
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án D
Các nguyên tố kim loại là: Natri (Na); Magie (Mg); Sắt (Fe); Nhôm (Al) => có 4 nguyên tố
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào bài cách viết công thức hóa học.
Giải chi tiết:
2 phân tử nitơ viết dưới dạng 2N2,
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào bảng 1 sgk hóa trang 42
Phân tử khối của H2SO4 là: MH2SO4 = 2×MH + MS + 4×MO = ? (đvC)
Giải chi tiết:
Phân tử khối của H2SO4 là: MH2SO4 = 2×1 + 32 + 4×16 = 98 đvC.
Câu 7:
): Xét các quá trình sau:
(1) Sữa để lâu bị chua.
(2) Cồn y tế để trong lọ không đậy nắp bị bay hơi.
(3) Enzim amilaza trong nước bọt biến đổi một phần tinh bột (đã chín) trong thức ăn thành đường mantozơ.
(4) Khi nhiệt độ nóng dần lên, băng ở hai cực tan ra.
(5) Ma trơi là hiện tượng photpho bốc cháy trong không khí tạo ra ngọn lửa màu xanh.
(6) Đun nóng iot rắn (màu đen) chuyển thành hơi iot (màu tím).
Hiện tượng hóa học là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào khái niệm về hiện tượng vật lí, hiện tượng hóa học
+ Hiện tượng vật lí: là sự biến đổi nhưng không làm thay đổi tính chất ban đầu của chất.
+ Hiện tượng hóa học: là sự biến đổi chất sinh ra chất mới, có tính chất khác với chất ban đầu
Giải chi tiết:
(1) sữa chua bị biến đổi thành chất khác có vị chua => là HTHH
(2) Cồn chỉ bay hơi chuyển từ thể lỏng sang thể hơi chứ không thay đổi tính chất => là HTVL
(3) tinh bột chuyển thành đường mantozơ => có tính chất khác ban đầu => là HTHH
(4) băng chỉ chuyển từ thể rắn sang thể lỏng => là HTVL
(5) photpho cháy sinh ra chất mới => là HTHH
(6) iot chỉ chuyển từ thể rắn sang thể hơi chứ không thay đổi tính chất => là HTVL
Vậy các hiện tượng hóa học là: (1), (3), (5).
Đáp án BChú ý khi giải:
Dấu hiệu nhận biết hiện tượng hóa học có thể là: sự thay đổi màu sắc dung dịch, có sủi bọt khí, phát sáng hoặc tỏa nhiệt.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào công thức tính thể tích của một chất khí ở đktc
VNH3(đktc) = nNH3×22,4 = ? (lít)
Giải chi tiết:
Thể tích của 0,4 mol NH3 (đktc) = 0,4×22,4 = 8,96 (lít)Câu 10:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng ta có:
mmagie,sắt,kẽm + moxi = mhh rắn
=> 13,2 + moxi = 18 => moxi = ?
Giải chi tiết:
Magie, sắt, kẽm + oxi → hỗn hợp rắn
Áp dụng định luật bảo toàn khối lượng ta có:
mmagie,sắt,kẽm + moxi = mhh rắn
=> 13,2 + moxi = 18
=> moxi = 18 – 13,2 = 4,8 (g)Câu 11:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Công thức tính phần trăm của nguyên tử N trong chất A
Ta thấy trong tất cả các chất đều có 2 nguyên tử N => mN trong các chất bằng nhau
=> Tính xem chất nào có MA nhỏ nhất thì chất đó chứa hàm lượng N lớn nhất
Giải chi tiết:
Xét 1 mol mỗi chất
M(NH2)2CO = (14 + 1.2).2 + 12 + 16 = 60 đvC
M(NH4)2SO4 = (14 + 1.4).2 + 32 + 16.4 = 132 đvC
MCa(NO3)2 = 40 + (14 + 16.3).2 = 164 đvC
MNH4NO3 = 14 + 1.4 + 14 + 16.3= 80 đvC
Vậy hàm lượng nito có trong phân Ure nhiều nhất
Câu 12:
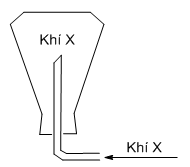
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Khí thu được bằng cách đặt úp bình => khí này có phân tử khối nặng hơn không khí (Mkk≈ 29 g/mol)
Giải chi tiết:
Khí thu được bằng cách đặt úp bình => khí này có phân tử khối nặng hơn không khí
=> khí X là khí CO2 (MCO2 = 44 g/mol)
Câu 13:
Lập công thức hóa học của hợp chất sau: H (I) và CO3 (II).
 Xem đáp án
Xem đáp án
Phương pháp giải:
Gọi công thức hợp chất có dạng với a, b lần lượt là hóa trị của A, B
Áp dụng quy tắc hóa trị ta có:
a.x = b.y
Chuyển thành tỉ lệ:
=> Chọn x = b’ ; y = a’ với a’, b’ là những số nguyên tối giản
Giải chi tiết:
Gọi công thức có dạng: Hx(CO3)y
áp dụng quy tắc hóa trị ta có: I. x = II.y
Chuyển thành tỉ lệ:
Chọn x = 2 và y= 1 => công thức là: H2CO3
Câu 14:
Lập công thức hóa học của các hợp chất sau: S (VI) và O (II).
 Xem đáp án
Xem đáp án
Phương pháp giải:
Gọi công thức hợp chất có dạng với a, b lần lượt là hóa trị của A, B
Áp dụng quy tắc hóa trị ta có:
a.x = b.y
Chuyển thành tỉ lệ:
=> Chọn x = b’ ; y = a’ với a’, b’ là những số nguyên tối giản
Giải chi tiết:
Gọi công thức có dạng: SxOy
áp dụng quy tắc hóa trị ta có: VI. x = II.y
Chuyển thành tỉ lệ:
Chọn x = 1 và y= 2 => công thức là: SO3
Câu 15:
Lập công thức hóa học của hợp chất sau: Ca (II) và NO3 (I).
 Xem đáp án
Xem đáp án
Phương pháp giải:
Gọi công thức hợp chất có dạng với a, b lần lượt là hóa trị của A, B
Áp dụng quy tắc hóa trị ta có:
a.x = b.y
Chuyển thành tỉ lệ:
=> Chọn x = b’; y = a’ với a’, b’ là những số nguyên tối giản
Giải chi tiết:
Gọi công thức có dạng: Cax(NO3)y
áp dụng quy tắc hóa trị ta có: II. x = I.y
Chuyển thành tỉ lệ:
Chọn x = 1 và y= 2 => công thức là: Ca(NO3)2
Câu 16:
Lập công thức hóa học của hợp chất sau: Al (III) và SO4 (II).
 Xem đáp án
Xem đáp án
Phương pháp giải:
Gọi công thức hợp chất có dạng với a, b lần lượt là hóa trị của A, B
Áp dụng quy tắc hóa trị ta có:
a.x = b.y
Chuyển thành tỉ lệ:
=> Chọn x = b’ ; y = a’ với a’, b’ là những số nguyên tối giản
Giải chi tiết:
Gọi công thức có dạng: Alx(SO4)y
áp dụng quy tắc hóa trị ta có: III. x = II.y
Chuyển thành tỉ lệ:
Chọn x = 2 và y= 3 => công thức là: Al2(SO4)3
Câu 17:
Fe + Cl2 → FeCl3
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cân bằng phương trình bằng một trong các phương pháp sau:
+ Phương pháp chẵn lẻ
+ Phân pháp nguyên tử - nguyên tố
+ Phương pháp phân số- thập phân
+ Phương pháp hóa trị
Giải chi tiết:
2 Fe + 3Cl2 → 2FeCl3 (Tỉ lệ 2:3:2)
Câu 18:
Lập phương trình hóa học của các sơ đồ phản ứng sau và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Mg + HCl → MgCl2 + H2
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cân bằng phương trình bằng một trong các phương pháp sau:
+ Phương pháp chẵn lẻ
+ Phân pháp nguyên tử - nguyên tố
+ Phương pháp phân số- thập phân
+ Phương pháp hóa trị
Giải chi tiết:
Mg + 2HCl → MgCl2 + H2 (Tỉ lệ 1:2:1:1)
Câu 19:
Lập phương trình hóa học của các sơ đồ phản ứng sau và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
NaOH + H2SO4 → Na2SO4 + H2O Xem đáp án
Xem đáp án
Phương pháp giải:
Cân bằng phương trình bằng một trong các phương pháp sau:
+ Phương pháp chẵn lẻ
+ Phân pháp nguyên tử - nguyên tố
+ Phương pháp phân số- thập phân
+ Phương pháp hóa trị
Giải chi tiết:
2 NaOH + H2SO4→Na2SO4 + 2H2O (Tỉ lệ 2:1:1:2)
Câu 20:
Lập phương trình hóa học của các sơ đồ phản ứng sau và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Cu + H2SO4 đặc → CuSO4 + SO2 + H2O
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cân bằng phương trình bằng một trong các phương pháp sau:
+ Phương pháp chẵn lẻ
+ Phân pháp nguyên tử - nguyên tố
+ Phương pháp phân số- thập phân
+ Phương pháp hóa trị
Giải chi tiết:
Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O (Tỉ lệ 1:2:1:1:2)
Câu 21:
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cân bằng phương trình bằng một trong các phương pháp sau:
Gọi công thức hóa học của X: CxOy (x, y ³ 1)
Phần trăm khối lượng của Oxi có trong X là: 100% - %mC = 72,73%
Ta có:
=> Công thức hóa học của X =?
Giải chi tiết:
Gọi công thức hóa học của X: CxOy (x, y ³ 1)
Phần trăm khối lượng của Oxi có trong X là: 100% - %mC = 72,73%
Ta có:
Chọn x = 1 và y =2
=> Công thức hóa học của X là CO2
Câu 22:
Hòa tan hoàn toàn 11,2 gam sắt (Fe) trong axit clohiđric (HCl) thu được muối sắt clorua (FeCl2) và khí hiđro (H2).
a. Viết phương trình hóa học xảy ra.
b. Tính thể tích khí hiđro (H2) thu được ở điều kiện tiêu chuẩn.
c. Tính khối lượng axit clohiđric (HCl) đã tham gia phản ứng.
 Xem đáp án
Xem đáp án
Phương pháp giải:
a. Fe + 2 HCl →FeCl2 + H2↑
Theo PT: 1 2 1 (mol)
Theo ĐB: 0,2 x = ? y = ? (mol)
b. Tìm ra
c. Tìm ra
Giải chi tiết:
a. Fe + 2 HCl →FeCl2 + H2↑
b.
Theo phương trình hóa học:
c. Theo phương trình hóa học:
mHCl = nHCl × MHCl = 0,4 × 36,5 = 14,6 (g)
Câu 23:
Đốt cháy hoàn toàn hỗn hợp A (Mg, Zn) trong bình đựng 2,688 (lít) khí oxi (O2) ở điều kiện tiêu chuẩn, thu được hỗn hợp chất rắn B (MgO, ZnO). Cho toàn bộ B tác dụng vừa đủ với m (g) axit clohiđric (HCl) thu được hỗn hợp D (MgCl2, ZnCl2) và nước. Tính giá trị của m.
 Xem đáp án
Xem đáp án
Phương pháp giải:
2Mg + O2 → 2MgO (1) MgO + 2HCl → MgCl2 + H2O (3)
x 2x 2x 4x
2Zn + O2 → 2ZnO (2) ZnO + 2HCl → ZnCl2 + H2O (4)
y 2y 2y 4y
Gọi x, y lần lượt là số mol của O2 phản ứng ở phương trình (1) và (2)
Theo phương trình (1),(2),(3) và (4) ta thấy:
nHCl = 4 nO2 = ? (mol)
=> Khối lượng của HCl là: mHCl = nHCl× MHCl = ? (g)
Giải chi tiết:
2Mg + O2 → 2MgO (1) MgO + 2HCl → MgCl2 + H2O (3)
x 2x 2x 4x
2Zn + O2 → 2ZnO (2) ZnO + 2HCl → ZnCl2 + H2O (4)
y 2y 2y 4y
Gọi x, y lần lượt là số mol của O2 phản ứng ở phương trình (1) và (2)
Theo phương trình (1) và (2) ta thấy:
n(MgO + ZnO) = 2nO2 = 2. 0,12 = 0,24 (mol)
Theo phương trình (3) và (4) ta thấy:
nHCl = 2 n(MgO + ZnO) = 2. 0,24 = 0,48 (mol)
=> Khối lượng của HCl là: mHCl = nHCl× MHCl = 0,48 ×36,5 = 17,52 (g)
