Đề kiểm tra cuối kì 2 Hóa 8 có đáp án (Mới nhất)
Đề kiểm tra cuối kì 2 Hóa 8 có đáp án (Mới nhất) (Đề 17)
-
739 lượt thi
-
9 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Cho dung dịch của các chất: NaCl, NaOH, HCl, H2SO4, Ba(OH)2. Nhận định nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dung dịch HCl, H2SO4 là dung dịch axit làm quỳ tím hóa đỏ.
Dung dịch NaCl là dung dịch muối không làm đổi màu quỳ tím.
Dung dịch NaOH, Ba(OH)2 là dung dịch bazơ làm quỳ tím hóa xanh.
Vậy có 2 dung dịch làm quỳ tím hóa xanh và 2 dung dịch làm quỳ tím hóa đỏ.
Câu 2:
Cho các chất: Ba, P2O5, ZnO, Cu, SO2, CaO. Có bao nhiêu chất phản ứng được với nước?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Có 4 chất phản ứng với nước là: Ba, P2O5, SO2, CaO.
Ba + 2H2O ⟶ Ba(OH)2 + H2↑
P2O5 + 3H2O ⟶ 2H3PO4
SO2 + H2O ⟶ H2SO3
CaO + H2O ⟶ Ca(OH)2
Câu 3:
Chọn phát biểu đúng về sự oxi hóa.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Sự oxi hóa là sự tác dụng của oxi với một chất khác.
Câu 4:
Cho 0,72g kim loại R có hóa trị II tác dụng vừa đủ với khí oxi ở nhiệt độ cao thu được 1,2g oxit. Kim loại R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
2R + O2 2RO
Theo phương trình: nR = nRO
⇒
⇒ MR = 24 (g/mol)
Vậy R là Mg.
Câu 5:
Nước là hợp chất tạo bởi hai nguyên tố oxi và hiđro. Chúng đã hóa hợp với nhau theo tỉ lệ thể tích là ...(1)... khí hiđro và ...(2)... khí oxi, theo tỉ lệ khối lượng là ...(3)... hiđro và ...(4)... oxi.
Chọn cụm từ thích hợp điềm vào chỗ chấm.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2H2 + O2 2H2O
Theo phương trình:
Tỉ lệ về số mol cũng là tỉ lệ về thể tích, do đó tức là 2 phần khí hiđro và 1 phần khí oxi.
Tỉ lệ khối lượng: tức là 1 phần hiđro và 8 phần oxi.
Câu 6:
Đun nóng 4,9g KClO3 ở nhiệt độ cao có xúc tác MnO2 cho đến khi phản ứng kết thúc, thu được V lít khí oxi ở đktc. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
2KClO3 2KCl + 3O2↑
= 0,04 (mol)
Theo phương trình: = = 0,06 (mol)
= 0,06.22,4 = 1,344 (lít)
Câu 7:
a. Viết phương trình của các chuyển đổi hóa học sau (mỗi mũi tên là một phương trình hóa học) và ghi rõ điều kiện phản ứng (nếu có):
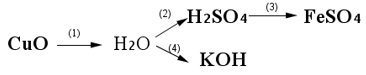
b. Hãy cho biết các hợp chất in đậm trong dãy chuyển hóa trên thuộc loại hợp chất nào (oxit, axit, bazơ, muối)? Gọi tên của chúng.
 Xem đáp án
Xem đáp án
a) Phương trình:
1) CuO + H2 Cu + H2O
2) H2O + SO3 ⟶ H2SO4
3) H2SO4 + Fe ⟶ FeSO4 + H2↑
4) K2O + H2O ⟶ 2KOH
b) CuO là oxit, tên là đồng(II) oxit.
H2SO4 là axit, tên là axit sunfuric.
FeSO4 là muối, tên là sắt(II) sunfat.
KOH là bazơ, tên là kali hiđroxit.
Câu 8:
a. Trình bày phương pháp hóa học phân biệt hai chất rắn CaO và MgO đựng trong hai lọ riêng biệt mất nhãn. Viết phương trình hóa học xảy ra (nếu có).
b. Nêu các biện pháp dập tắt sự cháy? Muốn dập tắt ngọn lửa do xăng dầu cháy (đám cháy nhỏ), người ta thường dùng vải dày hoặc phủ cát lên ngọn lửa mà không dùng nước, giải thích vì sao?
 Xem đáp án
Xem đáp án
a) Lấy mẫu thử cho vào các ống nghiệm riêng biệt có đánh số thứ tự.
- Nhỏ nước vào từng mẫu thử.
+ Mẫu thử tan dần là CaO.
CaO + H2O ⟶ Ca(OH)2
+ Mẫu thử không tan là MgO.
b. Các biện pháp dập tắt sự cháy:
- Hạ nhiệt độ chất cháy xuống dưới nhiệt độ cháy.
- Cách li chất cháy với khí oxi.
Muốn dập tắt ngọn lửa do xăng dầu cháy (đám cháy nhỏ), người ta thường dùng vải dày hoặc phủ cát lên ngọn lửa mà không dùng nước là vì dùng vải dày hoặc phủ cát lên ngọn lửa sẽ cách li xăng dầu với khí oxi. Còn nếu dùng nước thì xăng dầu không tan trong nước và nhẹ hơn nước nên khi tiếp xúc xăng dầu sẽ nổi lên trên mặt nước vẫn tiếp xúc được với khí oxi làm cho đám cháy lan rộng hơn.
Câu 9:
Cho 5,8g hỗn hợp X gồm Na và Na2O tác dụng với nước thu được dung dịch bazơ và 0,56 lít khí hiđro ở đktc.
a. Viết phương trình hóa học xảy ra.
b. Tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
c. Tính khối lượng của bazơ thu được?
Cho: Na = 23, Cu = 64, Mg = 24, Zn = 65, K = 39, Ca = 40, O = 16, H = 1, Cl = 35,5.
 Xem đáp án
Xem đáp án
a) Phương trình hóa học xảy ra:
(1) 2Na + 2H2O ⟶ 2NaOH + H2↑
(2) Na2O + H2O ⟶ 2NaOH
b) = = 0,025 (mol)
Theo phương trình (1): nNa = 2= 0,05 (mol)
mNa = 0,05.23 = 1,15 (g)
%mNa =
% = 100% − 19,83% = 80,17%
Vậy phần trăm khối lượng các chất có trong hỗn hợp X là: Na 19,83% và Na2O 80,17%.
c) = mhh X – mNa = 5,8 – 1,15 = 4,65 (g)
= 0,075 (mol)
Theo phương trình (1): nNaOH (1) = nNa = 0,05 (mol)
Theo phương trình (2): nNaOH (2) = 2 = 2.0,075 = 0,15 (mol)
⇒ nNaOH = nNaOH (1) + nNaOH (2) = 0,05 + 0,15 = 0,2 (mol)
mNaOH = 0,2.(23 + 16 + 1) = 8 (g)
Vậy khối lượng bazơ thu được là 8g.
