Lí thuyết về kim loại Nhôm
1. Lí thuyết
1.1 Khái niệm
Nhôm (bắt nguồn từ tiếng Pháp: aluminium) là tên của một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Al và số nguyên tử bằng 13.
1.2 Tính chất vật lí, hóa học
Tính chất vật lí
- Nhôm là một kim loại nhẹ, màu trắng bạc, nóng chảy ở nhiệt độ 660 độ C
- Nhôm rất dẻo, có thể dát được lá nhôm mỏng 0,01 mm dùng để gói thực phẩm
- Nhôm nằm ở nhóm IIIA và chu kì 3
- Nhôm có cấu trúc tinh thể là lập phương tâm diện
Tính chất hóa học
- Phản ứng với oxi và một số phi kim
Nhôm phản ứng với oxi tạo thành oxit và phản ứng với nhiều phi kim khác như S, Cl2 tạo thành muối.
Ví dụ:
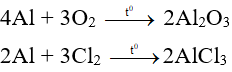
Chú ý: Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
- Phản ứng với axit (HCl, H2SO4 loãng,…) giải phóng H2.
Ví dụ:
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4 đặc nguội và HNO3 đặc, nguội,
- Phản ứng với dung dịch muối của kim loại yếu hơn.
Nhôm phản ứng được với nhiều dung dịch muối của những kim loại hoạt động hóa học yếu hơn tạo ra muối nhôm và kim loại mới.
Ví dụ:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
- Phản ứng với dung dịch kiềm
Đây là tính chất hóa học đặc biệt của nhôm so với các kim loại khác. Nhôm phản ứng với dung dịch kiềm giải phóng khí H2.
Ví dụ:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Ngoài ra, ở nhiệt độ cao nhôm còn có thể phản ứng được với nhiều oxit kim loại để tạo thành kim loại. Phản ứng này còn được gọi là phản ứng nhiệt nhôm.
Ví dụ:
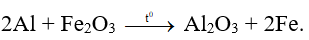
2. Bài tập vận dụng
Bài 1: Không được dùng chậu nhôm để chứa nước vôi trong do
A. nhôm tác dụng được với dung dịch axit.
B. nhôm tác dụng được với dung dịch bazơ.
C. nhôm đẩy được kim loại yếu hơn nó ra khỏi dung dịch muối.
D. nhôm là kim loại hoạt động hóa học mạnh.
Lời giải:
Đáp án B
Không được dùng chậu nhôm để chứa nước vôi trong, do nhôm có thể tác dụng được với dung dịch nước vôi trong theo phản ứng:
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2.
Bài 2: Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3 ?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện.
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần.
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan.
Lời giải:
Đáp án B
Hiện tượng:
Ngay lập tức xuất hiện kết tủa keo trắng, theo phản ứng:
3NaOH + AlCl3 → 3NaCl + Al(OH)3 (↓ keo trắng)
Sau đó kết tủa tan theo phản ứng:
Al(OH)3 + NaOH → NaAlO2 + 2H2O.
Bài 3: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo ở nhiệt độ cao tạo thành 53,4g muối. Kim loại M là
A. Na.
B. Fe.
C. Al.
D. Mg.
Lời giải:
Đáp án C
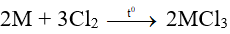
Bảo toàn khối lượng có:
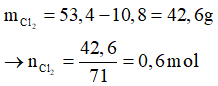
Theo PTHH có
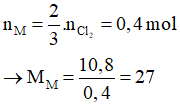
Vậy kim loại cần tìm là Al.
Bài 4: Cho 3,82 gam hỗn hợp hai kim loại Ba, Al vào lượng nước dư chỉ thu được dung dịch chứa duy nhất một muối. Khối lượng Ba có trong hỗn hợp là
A. 3,425 gam.
B. 1,644 gam.
C. 1,370 gam.
D. 2,740 gam.
Lời giải:
Đáp án D
Do sau phản ứng chỉ thu được dung dịch chứa một muối nên cả Ba và Al đều phản ứng hết.
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2
x……………….x mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2.
2x…….x mol
Theo PTHH có: mBa + mAl = 137x + 54x = 3,82 → x = 0,02 mol.
Vậy mBa = 137.0,02 =2,74 gam.
Bài 5: Hòa tan hoàn toàn 11 gam hỗn hợp bột các kim loại: Fe, Al trong dung dịch H2SO4 loãng, dư thu được dung dịch A và 8,96 lít H2 (đktc). Phần trăm khối lượng của nhôm trong hỗn hợp ban đầu là
A. 49,09%.
B. 50,91%.
C. 40,09%.
D. 59,01%.
Lời giải:
Đáp án A
Gọi số mol của Al và Fe lần lượt là x (mol) và y (mol)
mKL = 11 gam → 27x + 56y = 11 (gam) (1)
Phương trình hóa học:
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2 (↑)
x............................................................1,5x mol
Fe + H2SO4 (loãng) → FeSO4 + H2 (↑)
y...................................................y mol
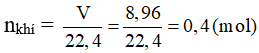
→ 1,5x + y = 0,4 (2)
Từ (1) và (2) có x = 0,2 mol và y = 0,1 mol
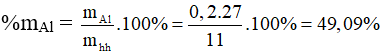
Bài 6: Hòa tan 25,8g hỗn hợp gồm bột Al và Al2O3 trong dung dịch HCl dư. Sau phản ứng người ta thu được 0,6g khí H2. Khối lượng muối AlCl3 thu được sau phản ứng là
A. 53,4 gam.
B. 79,6 gam.
C. 80,1 gam.
D. 25,8 gam.
Lời giải:
Đáp án C
2Al + 6HCl → 2AlCl3 + 3H2
0,2…………….0,2………0,3 mol
Al2O3 + 6HCl → 2AlCl3 + 3H2O
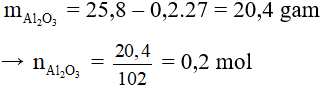
Bảo toàn nguyên tố Al có:
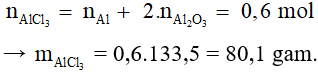
Bài 7: Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe2O3 nung nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe3O4 nung nóng.
D. Al tác dụng với axit H2SO4 đặc nóng.
Lời giải:
Đáp án D
Phản ứng của nhôm với oxit kim loại gọi là phản ứng nhiệt nhôm.
Bài 8: Có thể dùng hóa chất nào sau đây để phân biệt 3 chất rắn Mg, Al, Al2O3 đựng trong các lọ riêng biệt?
A. H2SO4 loãng.
B. NaOH.
C. HCl đặc.
D. NH3.
Lời giải:
Đáp án B
Cho từng chất rắn trong lọ tác dung với NaOH.
- Không có hiện tượng xảy ra → Mg.
- Chất rắn tan dần, có khí thoát ra → Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Chất rắn tan dần → Al2O3
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Bài 9: Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Giá trị của m là
A. 0,540 gam.
B. 0,810 gam.
C. 1,080 gam.
D. 1,755 gam.
Lời giải:
Đáp án C
Sản phẩm sau phản ứng tác dụng với dung dịch NaOH có khí thoát ra → Al dư
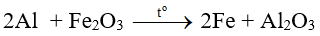
0,02…..0,01 mol
2Aldư + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,02……………………………………..0,03 mol
→ nAl = 0,02 + 0,02 = 0,04 mol → mAl = 0,04.27 = 1,08 gam.
Bài 10: Cho 5,4 gam bột nhôm tác dụng với 100 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là
A. 4,48 lít.
B. 0,672 lít.
C. 0,448 lít.
D. 6,72 lít.
Lời giải:
Đáp án B
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 0,02 mol
Sau phản ứng Al dư, NaOH hết
nkhí = 0,03 mol → V = 0,03.22,4 = 0,672 lít.
Xem thêm các dạng bài tập Hóa học khác:
Lí thuyết Kim loại tác dụng với axit H2SO4 (2024) chi tiết nhất
Lí thuyết về Kim loại kiềm thổ (2024) chi tiết nhất
Lí thuyết về kim loại kiềm (2024) chi tiết nhất




