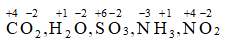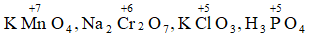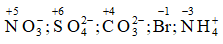Bài tập về xác định số oxi hóa
I. Lý thuyết và phương pháp giải
1. Khái niệm số oxi hóa
Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
2. Cách xác định số oxi hóa
Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết và điện tích của phân tử hoặc ion. Cách này gồm các quy tắc sau:
- Quy tắc 1: Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng không. Thí dụ: Số oxi hóa của Cu, Zn, oxygen, chlorine trong Cu, Zn, O2, Cl2…đều bằng không.
- Quy tắc 2: Trong phân tử, tổng số số oxi hóa của các nguyên tử bằng không.
Ví dụ: Tổng số oxi hóa của các nguyên tử trong phân tử NH3 là:
(-3) + 3 × (+1) = 0.
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ: Số oxi hóa của Na, Cl trong Na+, Cl- lần lượt bằng +1; -1; số oxi hóa của nguyên tử C và O trong CO32- lần lượt bằng +4 và -2.
- Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của hydrogen bằng +1, trừ hidride kim loại (, ,…). Số oxi hóa của oxygen bằng -2, trừ trường hợp và peroxide, superoxide (như ,…);
Lưu ý:
+ Các nguyên tố nhóm IA, IIA luôn có số oxi hóa +1, +2.
+ Ngoài ra, 4 quy tắc trên có thể được viết gộp thành 2 quy tắc (theo SGK Hóa học 10 – Cánh diều).
Cách 2: Dựa vào công thức cấu tạo
Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Ví dụ: Xác định số oxi hóa của C và O trong CO2.
Carbon dioxide (CO2) có công thức cấu tạo là: O = C = O.
Trong mỗi liên kết đôi C = O, C góp chung 2 electron, khi giả định CO2 là hợp chất ion thì hai electron này chuyển sang O. Vì có 2 liên kết C = O nên CO2 có công thức ion giả định là O2-C4+O2-. Từ đó xác định được số oxi hóa của O là -2 và của C là +4.
II. Bài tập vận dụng
Câu 1: Xác định số oxi hóa của mỗi nguyên tử trong các hợp chất: Fe2O3, Na2CO3.
Hướng dẫn giải:
Fe2O3
Số oxi hóa của O là -2. Gọi số oxi hóa của Fe là x ta có:
2.x + 3.(-2) = 0 → x = +3
Vậy trong hợp chất Fe2O3 số oxi hóa của Fe là +3, O là -2.
Na2CO3
Số oxi hóa của O là -2, Na là +1. Gọi số oxi hóa của C là x ta có:
2.(+1) + 1.x + 3.(-2) = 0 → x = +4
Vậy trong hợp chất Na2CO3 số oxi hóa của Na là +1, C là +4, O là +2.
Câu 2: Dựa vào công thức cấu tạo, xác định số oxi hóa của mỗi nguyên tử trong hợp chất CH4.
Hướng dẫn giải:
CH4gồm 1 nguyên tử C liên kết đơn với 4 nguyên tử H
Giả định CH4 là hợp chất ion, cặp electron lệch hoàn toàn về phía nguyên tử C (có độ âm điện cao hơn), trong mỗi liên kết đơn C-H có một electron của H bị chuyển sang C nên hợp chất ion giả định là
Vậy số oxi hóa của H là +1, C là -4.
Câu 3: Xác định số oxi hóa của mỗi nguyên tử trong các ion NO3-, NH4+.
Hướng dẫn giải:
NO3-
Số oxi hóa của O là -2. Gọi số oxi hóa của N là x ta có:
1.x + 3.(-2) = -1 → x = +5
Vậy trong ion NO3- số oxi hóa của N là +5, O là -2.
NH4+
Số oxi hóa của H là +1. Gọi số oxi hóa của N là x ta có:
1.x + 4.(+1) = +1 → x = -3
Vậy trong ion NH4+ số oxi hóa của N là -3, H là +1.
Câu 4: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Lời giải:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2- , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Câu 5: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Lời giải:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Câu 6: Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Lời giải:
Áp dụng quy tắc xác định số oxi hóa:
+) Phân tử:
+) Ion: Số oxi hóa của Na+ , Cu2+, Fe2+ , Fe3+, Al3+ lần lượt là: +1, +2, +2, +3, +3
Câu 7: Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4 , Na2Cr2O7, KClO3, H3PO4
Lời giải:
Số oxi hóa của Mn, Cr, P:
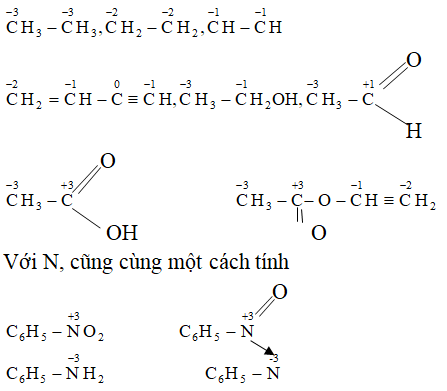
Câu 8: Xác định số oxi hóa của cacbon trong mỗi phân tử sau:
CH3 – CH3; CH2= CH2; CH≡ CH; CH2 =CH-C≡CH;
CH3 – CH2OH; CH3 – CHO; CH3- COOH; CH3COOCH =CH2;
C6H5 – NO2; C6H5 – NH2
Lời giải:
Câu 9: Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42- ; CO32- , Br, NH4+
Lời giải:
Số oxi hóa của N, S, C, Br:
Câu 10: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Hướng dẫn làm bài
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 bài tập về Phản ứng oxi hóa - khử (2024) có đáp án chi tiết nhất
30 Bài tập cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron (2024) có đáp án.
Thế nào là tính oxi hóa? Tính chất, ví dụ, bài tập (2024) hay nhất
30 Bài tập Xác định số oxi hóa của Nitơ (N) trong hợp chất (2024) có đáp án
30 Bài tập Xác định số oxi hóa của Sắt (Fe) trong hợp chất (2024) có đáp án