Lí thuyết kim loại tác dụng với HNO3
1. Lí thuyết
Kim loại tác dụng với HNO3
- HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
- Thông thường : HNO3 loãng → NO , HNO3 đặc → NO2 .
- Với các kim loại có tính khử mạnh : Mg, Al, Zn,… HNO3 loãng có thể bị khử đến N2O, N2, NH4NO3.
Cu + 4HNO3 (đặc)→ Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Chú ý : Fe, Al, Cr bị thụ động trong dung dịch HNO3 đặc, nguội do tạo màng oxit bền, bảo vệ kim loại khỏi tác dụng của axit → dùng bình Al hoặc Fe để đựng HNO3 đặc nguội.
* Au, Pt tan được trong nước cường toan (cường toan 3HCl : 1HNO3), không hòa tan được Ag vì tạo kết tủa AgCl.
Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
2. Bài tập vận dụng
Bài 1: Cho 11 gam hỗn hợp Al và Fe vào dung dịch HNO3 loãng, dư thì có 6,72 lít khí NO bay ra (đktc). Khối lượng Al trong hỗn hợp là
A. 5,4 gam.
B. 8,1 gam.
C. 2,7 gam.
D. 0,54 gam.
Đáp án: A. 5,4 gam.
nNO = 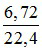 = 0,3 mol
= 0,3 mol
Gọi x, y lần lượt là số mol Al và Fe trong hỗn hợp
Khối lượng hỗn hợp là 11 gam nên 27x + 56y = 11 (1)
Phương trình hóa học:
Al + 4HNO3 → Al(NO3)3 + NO + H2O
x x
Fe + 4HNO3 → Fe(NO3)3 + NO + H2O
y y
→ nNO = x + y = 0,3 (2)
Từ (1) và (2) → 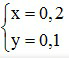
Khối lượng kim loại Al trong hỗn hợp bằng: mAl = 0,2.27 = 5,4 gam
Bài 2: Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 loãng thì thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là
A. 5,60.
B. 11,20.
C. 0,56.
D. 1,12.
Đáp án: D. 1,12.
Bài 3: Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau :
- Phần 1 tác dụng hoàn toàn với dung dịch HNO3 đặc, nguội thu được 0,672 lít khí.
- Phần 2 tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 0,448 lít khí.
Giá trị của m là (biết các thể tích khí được đo ở đktc)
A. 4,96 gam.
B. 8,80 gam.
C. 4,16 gam.
D. 17,6 gam.
Đáp án: C. 4,16 gam.
Hỗn hợp Cu, Fe khi tác dụng với dung dịch HNO3 đặc, nguội thì chỉ có Cu phản ứng :
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
mol: 0,015 ← 0,03
Hỗn hợp Cu, Fe khi tác dụng H2SO4 loãng thì chỉ có Fe phản ứng :
Fe + H2SO4 → FeSO4 + H2 (2)
mol: 0,02 ← 0,02
Theo (1), (2) và giả thiết ta có :
nCu = 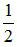 nNO2 = 0,015 mol; nFe = nHCl = 0,02
nNO2 = 0,015 mol; nFe = nHCl = 0,02
Khối lượng của Cu và Fe trong A là : m = 2(0,015.64 + 0,02.56) = 4,16 gam.
Bài 4: Khi cho 3 gam hỗn hợp Cu và Al tác dụng với HNO3 đặc, dư, đun nóng sinh ra 4,48 lít khí NO2 ở đktc (sản phẩm khử duy nhất). Phần trăm khối lượng kim loại Cu trong hỗn hợp là
A. 55,7%.
B. 45,5%.
C. 56,0%.
D. 47,0%.
Đáp án: A. 55,7%.
Bài 5: Hòa tan hết 0,02 mol Al và 0,03 mol Cu vào dung dịch HNO3,cô cạn dung dịch sau phản ứng và nung đến khối lượng không đổi thì thu được m gam chất rắn. Giá trị của m là
A. 3,42 gam.
B. 2,94 gam.
C. 9,9 gam.
D. 7,98 gam.
Đáp án:
Sơ đồ phản ứng :
2Al 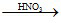 2Al(NO3)3
2Al(NO3)3 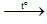 Al2O3 (1)
Al2O3 (1)
mol: 0,02 → 0,02 → 0,01
Cu 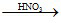 Cu(NO3)2
Cu(NO3)2 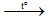 CuO (2)
CuO (2)
mol: 0,03 → 0,03 → 0,03
Áp dụng định luật bảo toàn nguyên tố cho sơ đồ (1), (2) ta thấy :
nAl2O3 = 0,01 mol; nCuO = 0,03
Vậy khối lượng chất rắn thu được là : 0,01.102 + 0,03.80 = 3,42 gam.
Bài 6: Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 loãng thu được 1,12 lít hỗn hợp X gồm 3 khí NO, N2O, N2 có tỉ lệ số mol là: 1 : 2 : 2. Giá trị của m là
A. 5,4 gam.
B. 3,51 gam.
C. 2,7 gam.
D. 8,1 gam.
Đáp án: B. 3,51 gam.
Bài 7: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là
A. 63% và 37%.
B. 36% và 64%.
C. 50% và 50%.
D. 46% và 54%.
Đáp án: B. 36% và 64%.
Xem thêm các dạng Bài tập Hóa học hay khác:
30 Bài tập công thức tính hiệu suất phản ứng (2024) có đáp án
30 Bài tập công thức tính liên kết pi (2024) có đáp án
30 Bài tập về cách viết công thức cấu tạo (2024) có đáp án
30 Bài tập về hợp chất vô cơ (2024) có đáp án chi tiết nhất
30 Bài tập về hoá hợp (2024) có đáp án chi tiết nhất




