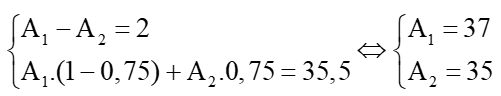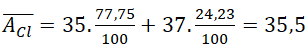Bài tập về cách tính khối lượng phân tử trung bình
I. Lý thuyết
1. Công thức tính nguyên tử khối trung bình của nguyên tố hóa học
- Giả sử một nguyên tố có 2 đồng vị X và Y. Kí hiệu X, Y đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó: nguyên tử khối trung bình (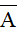 ) của nguyên tố này là:
) của nguyên tố này là:
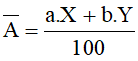
Chú ý: Một cách gần đúng, nguyên tử khối được lấy xấp xỉ bằng số khối.
2. Bạn nên biết
- Các đồng vị của cùng một nguyên tố là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó có số khối A khác nhau.
- Phần lớn các nguyên tố hóa học là hỗn hợp của nhiều đồng vị. Các đồng vị của cùng một nguyên tố hóa học có số nơtron trong hạt nhân khác nhau, nên có một số tính chất vật lí khác nhau.
- Có các đồng vị bền và các đồng vị không bền. Hầu hết các đồng vị có số hiệu nguyên tử Z > 82 là không bền, chúng còn được gọi là các đồng vị phóng xạ.
3. Mở rộng
Xác định nguyên tử khối trung bình cho nguyên tố có n đồng vị:
Công thức: 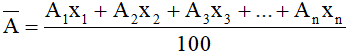
Trong đó: A1, A2, A3, .....An : là nguyên tử khối các đồng vị.
x1, x2, x3,.....xn : là thành phần % số nguyên tử của các đồng vị.

II. Bài tập vận dụng
Câu 1: Cacbon có hai đồng vị là 12C chiếm 98,89% và 13C là 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là:
A. 12,0111
B. 12,0219
C. 12,0525
D. 12,5245
Hướng dẫn
Nguyên tử khối trung bình của nguyên tố cacbon là:
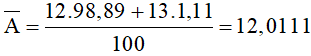
Đáp án A
Câu 2: Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là 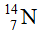 (99,63%) và
(99,63%) và 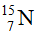 (0,37%). Nguyên tử khối trung bình của nitơ là:
(0,37%). Nguyên tử khối trung bình của nitơ là:
A. 14,7
B. 14,0
C. 14,4
D. 13,7
Hướng dẫn
Nguyên tử khối trung bình của nitơ là:
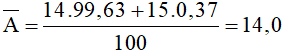
Đáp án B
Câu 3: Agon tách ra từ không khí là hỗn hợp ba đồng vị: 99,6% 40Ar; 0,063% 38Ar; 0,337% 36Ar. Nguyên tử khối trung bình của nguyên tố Agon là
A. 39,99
B. 37,99
C. 38,99
D. 35,99
Hướng dẫn:
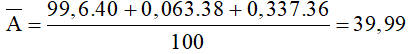
Đáp án A
Câu 4: Trong tự nhiên bromine có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92 amu. Tính % đồng vị 79Br trong tự nhiên.
Hướng dẫn giải
Gọi phần trăm đồng vị 79Br là a%.
⇒ Phần trăm của đồng vị 81Br là 100% - a%.
Nguyên tử khối trung bình của Br:
79.a+81.(100−a)100=72,92
⇒ a = 54,5.
Câu 5: Trong tự nhiên nguyên tố chlorine có 2 đồng vị: ACl và BCl chiếm 75%. Nguyên tử khối trung bình của nguyên tố Cl là 35,5 amu. Biết rằng A – B = 2. Xác định 2 đồng vị của Cl.
Hướng dẫn giải
Theo giả thiết ta có:
Vậy hai đồng vị của chlorine là 37Cl và 35Cl.
Câu 6. Nguyên tố clo có hai đồng vị bền 1735Cl chiếm 75,77% và 1737Cl chiếm 24,23%. Tính nguyên tử khối trung của clo?
A. 35 B. 35,5 C. 36 D. 37
Lời giải:
Đáp án: B
Nguyên tử khối trung bình của clo là:
Câu 7. Có 3 nguyên tử: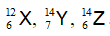
A. X, Y B. Y, Z C. X, Z D. X, Y, Z
Lời giải:
Đáp án: C
Đồng vị là những nguyên tử có cùng số proton ( số hiệu nguyên tử) khác nhau số khối
Thấy X, Z có cùng số proton là 6 , khác nhau số khối → X và Z là đồng vị của nguyên tố Cacbon.
Câu 8. Nguyên tử khối trung bình của đồng là 63,54. Trong tự nhiên, đồng có hai đồng vị 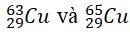
A. 28% B. 73% C 42% D. 37%
Lời giải:
Đáp án: B
Gọi x là % số nguyên tử của 2963Cu ⇒ 100 – x là % của 2965Cu
Ta có 63,54 = (63x + 65(100 - x))/100 ⇒ x = 73
Vậy 2963Cu chiếm 73%
Câu 9. Trong tự nhiên có hai đồng vị bền: 1737Cl chiếm 24,23% tổng số nguyên tử, còn lại là 1735Cl. Thành phần % theo khối lượng của 1737Cl trong HClO4 là:
A. 8,92% B. 8,43% C. 8,56% D. 8,79%
Lời giải:
Đáp án: A
Câu 10. Nguyên tố cacbon có hai đồng vị bền: 12Cchiếm 98,89% và 13C chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là
A. 12,5245 B. 12,0111 C. 12,0219 D. 12,0525
Lời giải:
Đáp án: B
Mtb = 98.89% x 12 + 1.11% x 13 = 12,0111
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
50 Bài tập về cấu trúc lớp vỏ electron nguyên tử (2024) có đáp án chi tiết nhất
30 Bài tập tính số hạt trong nguyên tử (2024) có đáp án chi tiết nhất
30 Bài tập về Mô hình nguyên tử và orbital nguyên tử (2024) có đáp án chi tiết nhất
50 Bài tập Cấu tạo nguyên tử (2024) có đáp án chi tiết nhất
50 Bài tập thành phần của nguyên tử (2024) có đáp án chi tiết nhất