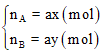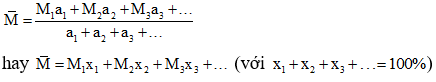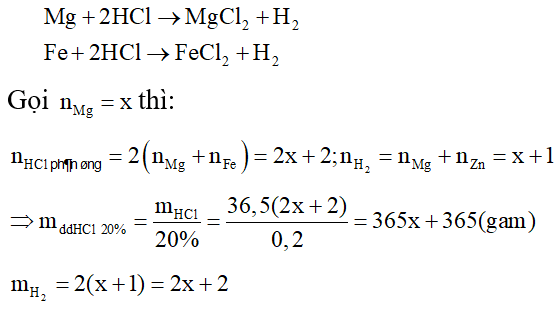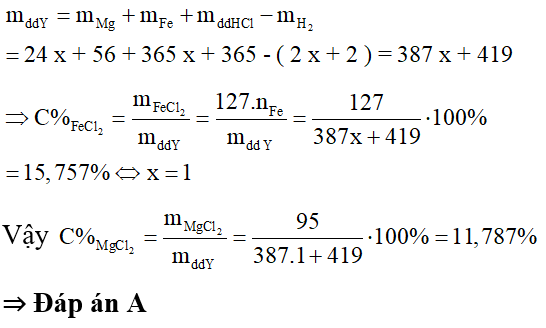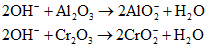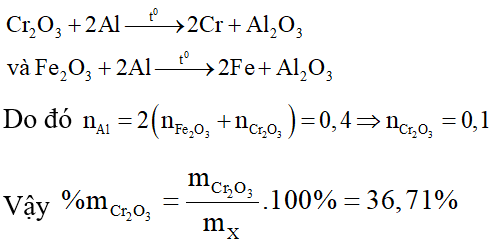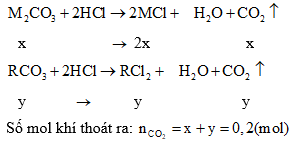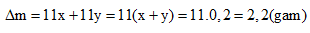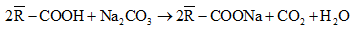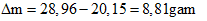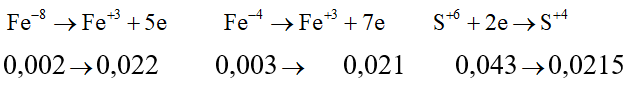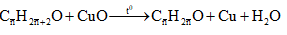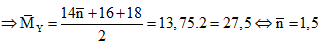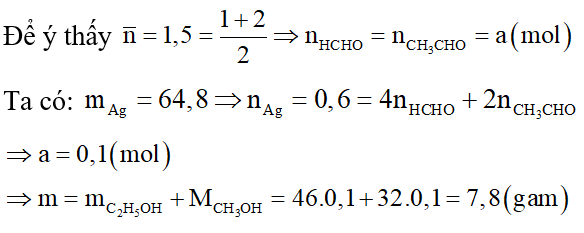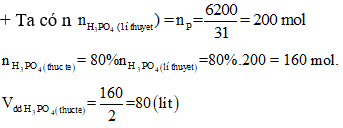Bài tập về các phương giải trong hóa học
I. Phương pháp giải
A. Phương pháp bảo toàn điện tích
1. Nội dung
+ Nguyên tử, phân tử, dung dịch luôn trung hòa về điện
+ Trong nguyên tử: Số proton = số electron
+ Trong dung dịch: số mol x điện tích âm = số mol x điện tích dương
2. Phạm vi sử dụng
+ Đối với bài toán dung dịch
+ Trong bài toán có xuất hiện các chất điện li mạnh: muối, axit, bazơ
Chú ý: Với phương pháp này thường sử dụng kết hợp với các phương pháp sau:
+ Bảo toàn khối lượng
+ Bảo toàn nguyên tố
+ Viết phương trình ion rút gọn
`Phương pháp này thường chỉ sử dụng với bài toàn vô cơ
B. Phương pháp bảo toàn electron
1. Nội dung
Trong phản ứng oxi hóa khử:
Số electron nhường = Số electron nhận
Số mol electron nhường = Số mol electron nhận
2. Phạm vi sử dụngM
+ Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ
+ Khi gặp bài toán có sử dụng HNO3, H2SO4 đặc nóng
Chú ý:
+ Xác định chính xác chất khử, chất oxi hóa ( dựa vào sự thay đổi số oxi hóa của các nguyên tử trong các chất)
+ Có thể áp dụng bảo toàn e cho một số phương trình, nhiều phương trình hoặc toàn bộ quá trình
+ Xác định các chất nhường và nhận e. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố
+ Khi áp dụng phương pháp bảo toàn e thường sử dụng kèm các phương pháp bảo toàn khác ( khối lượng, nguyên tố)
C. Phương pháp bảo toàn khối lượng
1. Nội dung
mtham gia = msản phẩm
Đối với bài toán sử dụng các chất dư sau phản ứng ta có:
mtrước pư = msau pư
Chú ý: Đối với các phản ứng tạo thành chất kết tủa, bay hơi, khối lượng dung dịch sẽ thay đổi sau phản ứng:
mdd sau phản ứng = mdd trước phản ứng + mchất tan – mkết tủa – mbay hơi
2. Phạm vi sử dụng
Thường sử dụng phương pháp bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban đầu ( tham gia) tính khối lượng chất tạo thành sản phẩm hoặc ngược lại
+ Trong bài toán có n chất mà chúng ta biết khối lượng của (n-1) chất ta sẽ tính được khối lượng chất còn lại
+ Những bài toán ta không thể xác định được số mol do không biết được phân tử khối của các chất
D. Phương pháp bảo toàn nguyên tố
1. Nội dung
Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng là luôn bằng nhau
2. Phạm vi sử dụng
Trong các phản ứng hóa học các nguyên tố luôn được bảo toàn
⇒ Số mol nguyên tử của một nguyên tố X bất kì trước và sau phản ứng bằng nhau
Hầu hết tất cả các dạng bài tập đều có thể sử dụng phương pháp bảo toàn nguyên tố, đặc biệt là các dạng bài hỗn hợp nhiều chất, xảy ra biến đổi phức tạp. Thường sử dụng trong các trường hợp sau:
+ Từ nhiều chất ban đầu tạo thành sản phẩm
Từ dữ kiện đề bài ⇒ số mol của nguyên tố X trong các chất ban đầu ⇒ tổng số mol trong sản phẩm ⇒ số mol sản phẩm
+ Từ một chất ban đầu tạo thành hỗn hợp nhiều sản phẩm
Từ dữ kiện đề bài ⇒ Tổng số mol ban đầu, số mol của các hợp phần đã cho ⇒ số mol chất cần xác định
+ Từ nhiều chất ban đầu tạo thành nhiều sản phẩm
Đối với dạng bài này không cần thiết phải tìm chính xác số mol của từng chất, chỉ quan tâm: 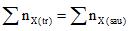
+ Đốt cháy để phân tích thành phần nguyên tố của hợp chất
Chú ý:
+ Hạn chế viết phương trình phản ứng mà viết sơ đồ phản ứng biểu diễn sự biến đổi của nguyên tố đang cần quan tâm
+ Từ số mol của nguyên tố chúng ta quan tâm sẽ tính ra được số mol của các chất
+ Số mol nguyên tố trong hợp chất bằng số nguyên tử của nguyên tố đó trong hợp chất nhân với số mol hợp chất chứa nguyên tố đó
Giả sử ta có hợp chất AxBy có số mol là a (mol).
Khi đó số mol nguyên tố A và B trong hợp chất là:
E. Phương pháp đường chéo
1. Nội dung
+ Phương pháp này áp dụng cho các bài toán hỗn hợp chứa 2 thành phần mà yêu cầu của bài là xác định tỉ lệ giữa 2 thành phần đó.
+ Ta có thể sử dụng đặt ẩn – giải hệ để thay thế cho phương pháp đường chéo, tuy nhiên áp dụng đường chéo hợp lí, đúng cách trong nhiều bài toán sẽ giúp tốc độ làm bài nhanh hơn.
2. Phạm vi sử dụng
+ Bài toán về đồng vị: Ta áp dụng sơ đồ đường chéo cho đại lượng khối lượng phân tử và số khối
+ Bài toán hỗn hợp khí: Ta áp dụng sơ đồ đường chéo cho tỉ lệ mol tương ứng với tỉ lệ chênh lệch phân tử khối các chất so với giá trị trung bình
+ Bài toán pha chế: Ta áp dụng sơ đồ đường chéo cho các đại lượng C%, CM, d,…
+ Bài toán xác định công thức, tính tỉ lệ các chất: Ta áp dụng cho các đại lượng, phân tử khối trung bình, số nguyên tử trung bình,…
F. Phương pháp trung bình
1. Nội dung
Giả sử hỗn hợp gồm các phần tử A1,A2,A3,... có khối lượng mol lần lượt là M1, M2, M3,…có số mol mỗi phần tử lần lượt là a1, a2, a3... hoặc ta có phần trăm số mol mỗi phần tử là x1, x2, x3,....
Ta sẽ tính được khối lượng mol trung bình ( ) theo công thức:
2. Phạm vi sử dụng
+ Bài toán có nhiều hỗn hợp có tính chất hóa học tương tự nhau
Thay vì ta viết nhiều phương trình hóa học cho nhiều chất, thì ta gọi công thức trung bình và viết một phương trình đại diện
+ Bài toán xác định thành phần %
+ Bài toán xác định nguyên tố, công thức phân tử
Chú ý:
- Một số bài tập thường có sự kết hợp giữa phương pháp trung bình và phương pháp đường chéo để rút ngắn thời gian tính toán.
- Với mọi giá trị trung bình ta luôn có hệ thức 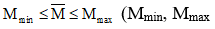
- Nếu các chất trong hỗn hợp có số mol bằng nhau ⇒ Gía trị trung bình bằng trung bình cộng và ngược lại
G. Phương pháp quy đổi
1. Nội dung
Quy đổi là phương pháp biến đổi toán học đưa bài toán ban đầu với một hỗn hợp các chất phức tạp trở thành một bài toán đơn giản hơn, qua đó làm các phép tính trở nên ngắn gọn, dễ dàng.
2. Phạm vi sử dụng
Khi gặp các bài toán hỗn hợp nhiều chất nhưng bản chất chỉ gồm 2 ( hoặc 3) nguyên tố:
+ Bài toán về hỗn hợp hợp chất của Fe, Cu,…
+ Bài toán về hỗn hợp đồng đẳng, thủy phân hóa, hiđro hóa, ankan hóa,…
Chú ý:
Số electron nhường, nhận không đổi
- Trong quá trình tính toán theo phương pháp quy đổi đôi khi ta gặp số âm đó là do sự bù trừ khối lượng của các chất trong hỗn hợp. Trong trường hợp này ta vẫn tính toán bình thường và kết quả cuối cùng vẫn thỏa mãn.
- Khi giả định hỗn hợp các chất thành một chất thì chất đó có thể không có thực, hệ số của các nguyên tử trong công thức có thể không phải là số tự nhiên mà có thể là số thập phân dương.
- Phương pháp quy đổi mặc dù được coi là phương pháp rất hay dùng để giải quyết một số bài toán liên quan đến Fe và hợp chất của Fe ... Tuy nhiên nếu chỉ áp dụng phương pháp quy đổi thì ta không thể giải toán nên khi áp dụng phương pháp quy đổi ta cần phải kết hợp với các phương pháp khác như:
+ Định luật bảo toàn khối lượng
+ Định luật bảo toàn nguyên tố
+ Định luật bảo toàn electron
+ Định luật bảo toàn điện tích
H. Phương pháp tăng giảm khối lượng
1. Nội dung
+ Mọi sự biến đổi hóa học ( được mô tả bằng phương trình phản ứng) đều có liên quan đến tăng hoặc giảm khối lượng.
+ Dựa vào sự tăng hoặc giảm khối lượng khi chuyển 1 mol chất X thành 1 hoặc nhiều mol chất Y ( có thể qua các giai đoạn trung gian) ta dễ dàng tính được số mol của các chất và ngược lại. từ số mol hoặc quan hệ số mol của các chất ta sẽ biết được sự tăng giảm khối lượng của các chất X,Y.
Chú ý:
+ Xác định đúng mối liên hệ tỉ lệ giữa các chất đã biết với chất cần xác định, sử dụng định luật bảo toàn nguyên tố để xác định chính xác tỉ lệ này
+ Xác định khi chuyển từ chất X thành Y ( hoặc ngược lại) thì khối lượng tăng lên hoặc giảm đi theo tỉ lệ phản ứng và theo đề bài cho
+ Lập phương trình toán học để giải
2. Phạm vi sử dụng
+ Các bài toán hỗn hợp nhiều chất.
+ Chưa biết rõ phản ứng xảy ra hoàn toàn hay không hoàn toàn
+ Các bài toán liên quan đến phản ứng thế
+ Các bài toán về nhiệt luyện
I. Phương pháp sử dụng phương trình ion thu gọn
1. Nội dung
Phương trình hóa học thường được viết dưới hai dạng là phương trình hóa học ở dạng phân tử và dạng ion rút gọn. Ngoài việc thể hiện đúng bản chất của phản ứng hóa học, phương trình ion thu gọn còn giúp giải nhanh rất nhiều dạng bài tập khóa học không thể giải theo các phương trình hóa học ở dạng phân tử.
2. Phạm vi sử dụng
Vì để rút gọn phương trình phân tử thành phương trình ion rút gọn ta sử dụng cho các chất điện li mạnh, do vậy phương pháp này áp dụng chủ yếu cho các chất axit bazơ, muối trong vô cơ ( các chất hữu cơ thường là chất điện li yếu)
+ Phản ứng axit, bazơ và xác định pH của dung dịch
+ Bài toán CO2 , SO2 tác dụng với dung dịch bazơ
+ Bài toán liên quan tới oxit, hiđroxit lưỡng tính
+ Bài toán chất khử tác dụng với dung dịch chứa H+ và NO3-
+ Các phản ứng ở dạng ion thu gọn tạo ra chất kết tủa, chất dễ bay hơi, chất điện li yếu
K.Phương pháp chọn đại lượng thích hợp
1. Nội dung
Có một số bài toán tưởng như thiếu dữ kiện gây bế tắc cho việc tính toán vì vậy ta phải tự chọn một đại lượng phù hợp để phục vụ cho việc giải toán
2. Phạm vi sử dụng
Khi chúng ta gặp bài toán có dạng: Đề bài cho dưới dạng tổng quát ( không có giá trị xác định) hoặc cho tỉ lệ thể tích tỉ lệ số mol các chất
+ Chọn mol nguyên tử hoặc phân tử chất tham gia
+ Chọn một mol hỗn hợp các chất tham gia phản ứng
+ Chọn đúng tỉ lệ lượng chất trong đầu bài đã cho
+ Chọn cho thông số một giá trị phù hợp để đơn giản phép tính
L. Phương pháp đồ thị
Các dạng bài sử dụng khảo sát đồ thị:
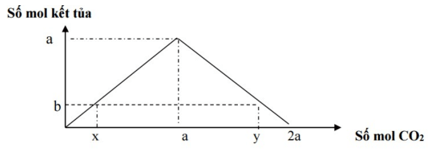
+ Bài toán cho CO2 (SO2) tác dụng với dung dịch Ca(OH)2 hoặc Ba(OH)2
Phương trình:
CO2 + 2OH- → CO32- + H2O
Khi CO2 dư tiếp tục xảy ra phản ứng
CO2 + CO32- → HCO3-
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại, sau đó tan dần đến hết
- n↓ cực đại = a = nCO2
- Nếu 0 < n↓ < a ⇒ Có 2 giá trị của CO2
TH1: CO2 thiếu tạo kết tủa chưa cực đại: nCO2 = a
TH2: CO2 dư tạo kết tủa cực đại sau đó hòa tan kết tủa:
nCO2 = 2a – n ↓= nOH- - n ↓
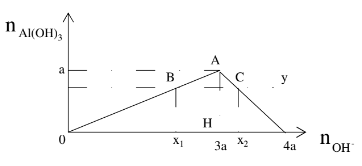
+ Bài toán liên quan tới muối Al3+ tác dụng với OH-
Phương trình:
Al3+ + 3OH- → Al(OH)3
Nếu OH- dư tiếp tục xảy ra phản ứng:
Al(OH)3 + OH- → AlO2- + 2H2O
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại sau đó tan dần đến hết
- n↓cực đại = a khi đó nOH- = 3a
- Nếu 0 < n↓ < a thì có 2 trường hợp của OH-
TH1: n↓ tạo ra chưa cực đại nOH- = 3n↓;
TH2: n↓ đạt cực đại sau đó lại tan khi đó nOH- = 4a – n↓
+ Muối AlO2- tác dụng với dung dịch H+
Phương trình:
AlO2- + H+ + H2O → Al(OH)3
Khi H+ dư tiếp tục xảy ra phản ứng:
Al(OH)3 + 3H+ → Al3+ + 3H2O
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại, sau đó tan cho đến hết
- n↓cực đại = a khi đó nH+ = a
- 0 < n ↓ < a khi đó có 2 trường hợp:
TH1: Kết tủa chưa đạt cực đại: n↓ = nH+
TH2: Kết tủa đạt cực đại sau đó bị H+ hòa tan: nH+ = 4a – 3n↓
II. Bài tập vận dụng
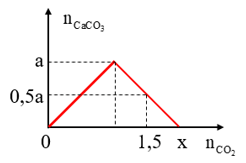
Câu 1: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình
Giá trị của x là:
A. 1,8 mol.
B. 2,2 mol.
C. 2,0 mol.
D. 2,5 mol.
Giải:
Dựa theo đồ thị xác định được: Khi nCO2 = 1,5 kết tủa đã đạt cực đại và bị hòa tan
⇒ nCO2 = 1,5 = 2n↓ cực đại – n↓ = 2a – 0,5a = 1,5a
⇒ a = 1
Khi nCO2 = x kết tủa đã bị hòa tan hết ⇒ nCO2 = 2n ↓ cực đại = 2a = 2
⇒ Đáp án : C
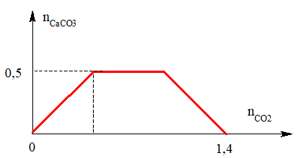
Câu 2: Khi sục từ từ đến dư CO2 vào dung dịch hỗn hợp gồm a mol Ca(OH)2 và b mol NaOH, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
A. 4 : 5.
B. 5 : 4.
C. 2 : 3.
D. 4 : 3.
Giải:
Dựa theo đồ thị ta có:
Khi kết tủa đạt cực đại nCaCO3 = nCa(OH)2 = a = 0,5 mol
Khi nCO2 = 1,4 khi đó CO32- bị hòa tan hết
⇒ nCO2 = nOH- = 2a + b = 1,4
⇒ b = 0,4
⇒ a : b = 0,5 : 0,4 = 5 : 4
⇒ Đáp án B.
Câu 3: Hòa tan hết hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20% thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,757%. Nồng độ của MgCl2 trong dung dịch Y là:
A. 11,787%
B. 84,243%
C. 88,213%
D. 15,757%
Giải
Để đơn giản cho quá trình tính toán, ta sẽ chọn số mol Fe trong hỗn hợp ban đầu là 1 và đi tìm số mol của Mg tương ứng khi đó dựa vào các điều kiện giả thiết.
Do đó, theo định luật bảo toàn khối lượng ta có:
Câu 4: Khi cho 41,4 gam X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư), sau phản ứng được 16 gam chất rắn. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm, phải dùng 10,8 gam Al. Phần trăm khối lượng của Cr2O3 trong X là (H= 100%)
A. 50,67%.
B. 20,33%.
C. 66,67%.
D. 36,71%.
Giải:
Khi cho X vào dung dịch NaOH đặc, dư có các phản ứng:
Do đó 16 gam chất rắn còn lại sau phản ứng là khối lượng của Fe2O3. Ta có: nFe2O3 = 0,1 , nAl = 0,4 .
Các phản ứng nhiệt nhôm diễn ra:
⇒Đáp án D
Câu 5: Hòa tan 23,8 g muối M2CO3 và RCO3 vào HCl thấy thoát ra 0,2 mol khí. Cô cạn dung dịch thu được bao nhiêu gam muối khan.
Giải
Gọi số mol của M2CO3 là x, của RCO3 là y, phương trình phản ứng xảy ra:
Áp dụng phương pháp tăng giảm khối lượng, ta có:
Sau phản ứng khối lượng muối tăng:
Câu 6: Cho 20,15 gam hỗn hợp 2 axit no đơn chức tác dụng vừa đủ với dung dịch Na2CO3 thì thu được V lít khí CO2 (đktc) và dung dịch muối. Cô cạn dung dịch thì thu được 28,96 gam muối. Giá trị của V là?
Giải
Gọi công thức tổng quát trung bình của 2 axit là: R-COOH
Phương trình phản ứng:
Theo PTHH có:
1 mol axit tạo ra 1 mol muối tăng: 23-1 = 22g
Theo đề bài, khối lượng tăng:
⇒ n axit = 8,81/22 = 0,4 mol
⇒ n CO2 = ½ n axit = 0,2 mol ⇒ V CO2 = 0,2.22,4 = 4,48 lít
Câu 7: Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH = 2. Thể tích của dung dịch X là
A. 2,00 lit.
B. 1,150 lit.
C. 1,114 lit.
D. 2,281it
Giải
Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S+4.
Khi đó, có các quá trình nhường và nhận electron như sau:
Cách 2: Quy đổi hỗn hợp các chất
Quy đổi hỗn hợp ban đầu thành Fe và S.
⇒Đáp án D
Câu 8: Cho m gam hỗn hợp X gồm hai ancol no, đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng với CuO đun nóng, thu được một hỗn hợp rắn Z và một hỗn hợp hơi Y (có tỉ khối với H2 là 13,75). Cho toàn bộ Y phản ứng với một lượng dư Ag2O (hoặc AgNO3 trong NH3 nung nóng, sinh ra 64,8 g Ag. Giá trị của m là:
A. 7,8.
B. 8,8.
C. 7,4.
D. 9,2.
Giải
Vì X gồm hai ancol no, đơn chức, kế tiếp nhau trong dãy đồng đẳng nên:
Gọi công thức chung của hai ancol là: CnH2n+2O .
Có phương trình phản ứng:
Sau phản ứng ta thu được hỗn hợp rắn Z suy ra sau phản ứng CuO dư.
Mà Y tác dụng với dung dịch AgNO3/ NH3 sinh ra Ag.
Nên hỗn hợp Y gồm anđehit và nước.
Theo phản ứng ta có: n anđehit = n nước
Vậy hỗn hợp gồm 2 anđehit là HCHO và CH3CHO.
⇒ Đáp án A.
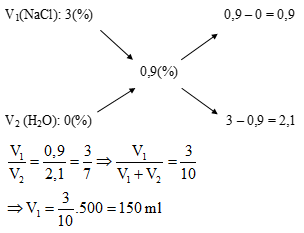
Câu 9: Để pha được 500 ml dung dịch nước muối sinh lí (C = 0,9%) cần lấy V ml dung dịch NaCl 3%. Giá trị của V là:
A. 150
B. 214,3
C. 285,7
D. 350
Giải:
Ta có sơ đồ:
⇒ Đáp án A
Câu 10: Từ 6,2 gam photpho điều chế được bao nhiêu lít dung dịch H3PO4 2M (hiệu suất toàn bộ quá trình phản ứng là 80%).
A. 100 lít.
B. 80 lít.
C. 40 lít.
D. 64 lít.
Giải:
+ Nhận thấy lượng P ban đầu được bảo toàn thành P trong HNO3 80% vì hiệu suất cả quá trình điều chế là 80%.
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
50 Bài tập về cân bằng hóa học 2024 (có đáp án)
Tổng hợp So sánh bán kính nguyên tử và bán kính ion chi tiết nhất
Tổng hợp các cách nhận biết các chất Hóa học (2024) chi tiết nhất
Tổng hợp Công thức cấu tạo của một số chất thường gặp (chương trình mới) 2024 chi tiết nhất
Tổng hợp các cách điều chế muối (2024) chi tiết nhất