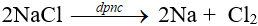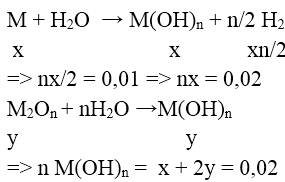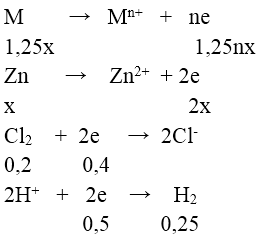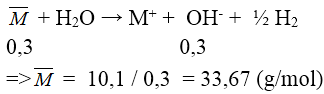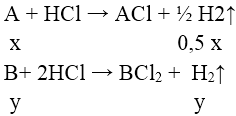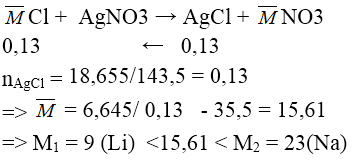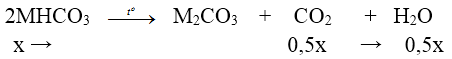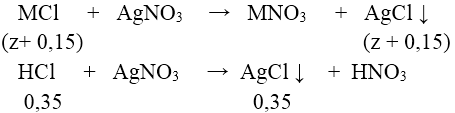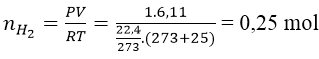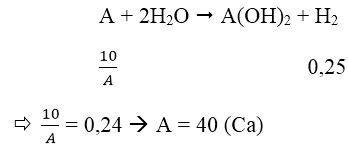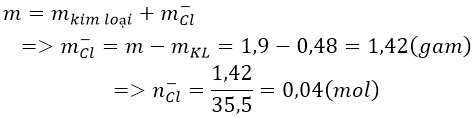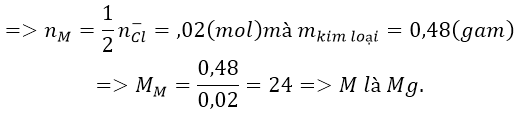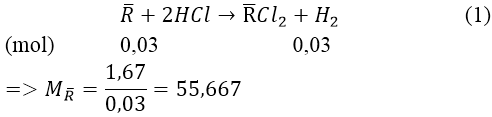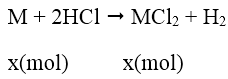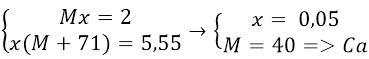Lí thuyết về kim loại kiềm
1. Lí thuyết
1.1 Vị trí, cấu tạo
Vị trí
- Các kim loại kiềm gồm Li, Na, K, Rb, Cs, Fr.
- Các kim loại kiềm đứng đầu mỗi chu kì (trừ chu kì 1).
Cấu tạo
- Cấu hình electron nguyên tử: ns1.
- Các kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất so với các kim loại khác. Từ Li đến Fr, I1 giảm dần.
- Cấu tạo đơn chất: các đơn chất nhóm IA đều có cấu tạo mạng lập phương tâm khối.
1.2 Tính chất vật lí, hóa học
Tính chất vật lí
- Liên kết kim loại yếu
- Là những kim loại rất nhẹ và mềm, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi thấp, giảm từ Li đến Fr.
- Độ cứng nhỏ
Tính chất hóa học
- Các kim loại kiềm có tính khử mạnh: M → M+ + 1e.
- Trong mọi hợp chất, kim loại kiềm có số oxi hóa +1.
Tác dụng với phi kim: O2, halogen, S,...
Chú ý:
- Tác dụng với oxi khô tạo peoxit: 2Na + O2 → Na2O2 (r)
- Tác dụng với oxi không khí khô ở nhiệt độ phòng tạo Na2O.
Tác dụng với axit: 2M + 2H+ → 2M+ + H2
Na + HCl → NaCl + 1/2 H2↑
Na dư + H2O → NaOH + 1/2 H2↑
Tác dụng với nước: 2M + 2H2O → 2MOH(dd) + H2
Na + H2O → NaOH + 1/2 H2
Tác dụng với dd muối
Khi cho Na tác dụng với dd muối CuSO4 sẽ có bọt khí và kết tủa Cu(OH)2 màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Khi cho kim loại kiềm vào dung dịch muối, đầu tiên kim loại kiềm sẽ tác dụng với nước sau đó bazo sinh ra có thể tác dụng với muối.
1.3 Ứng dụng và điều chế
Ứng dụng
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy.
- K, Na dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
- Cs dùng chế tạo tế bào quang điện.
- Dùng để điều chế một số kim loại quí hiếm bằng phương pháp nhiệt luyện.
- Dùng làm xúc tác trong nhiều phản ứng hữu cơ.
Điều chế
Điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
Ví dụ:
2. Bài tập vận dụng
Bài 1: Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
A. K
B. Na
C. Ba
D. Ca
Lời giải:
Đáp án: C
M: x mol ; M2On: y mol
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
Bài 2: Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là
A. Mg
B. Al
C. Ca
D. Na
Lời giải:
Đáp án: A
Bảo toàn e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M + 65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
Bài 3: Hòa tan hết 10,1 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước thu được 3 lít dung dịch có pH = 13. Hai kim loại kiềm đó là:
A. Na, K
B. Li, Na
C. K, Rb
D. Rb, Cs
Lời giải:
Đáp án: A
pH = 13 ⇒ [OH-] = 0,1M ⇒ n OH- = 0,3 mol
Bài 4: Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A. Natri , magie
B. Liti và beri
C. Liti và beri
D. Kali , bari
Lời giải:
Đáp án: A
⇒ nH2 = 0,5x + y = 0,25 ⇒ 0,25 < x + y < 0,5
⇒ 7,1/0,5 < M— < 7,1/0,25 ⇒ 14,2 < M— < 28,4
Chỉ có cặp nghiệm A = 23 (Na ) , B = 24 (Mg) thỏa mãn
Bài 5: Hòa tan hòa toàn 6,645g hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì liên tiếp nhau vào nước được dd X. Cho toàn bộ dd X tác dụng hoàn toàn với dd AgNO3 (dư), thu được 18,655g kết tủa. Hai kim loại kiềm trên là :
A. Na, K
B. Rb, Cs
C. Li , Na
D. K , Rb
Lời giải:
Đáp án: C
Bài 6: Hỗn hợp X gồm M2CO3, MHCO3, MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 gam chất rắn. Cũng đem 20,29 gam hỗn hợp X tác dụng hết với 500ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y.Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 gam kết tủa. Kim loại M là
A. Na
B. Li
C. K
D. Cs
Lời giải:
Đáp án: C
+) Nung X:
⇒ ∆m giảm = mCO2 + mH2O ⇒ 31x = 20,29 – 18,74 ⇒ x = 0,05 mol
+) X + HCl:
⇒ nCO2 = y + 0,05 = 0,15 ⇒ y = 0, 1 mol
Dung dịch Y chứa MCl và HCl dư. Gọi z là số mol MCl có trong X ta có:
⇒ nAgCl = 0,5 + z = 74,62/143,5 = 0,52 ⇒ z = 0,02
⇒(2M + 60).0,1 + (M + 61). 0,05 + (M + 35,5).0,02 = 20,29 ⇒ M = 39(K)
Bài 7: Cho 10g một kim loại kiềm thổ tác dụng với H2O, thu được 6,11 lít khí H2 (ở 25℃ và 1 atm). Hãy xác định tên của kim loại kiềm thổ đã dùng.
A. Mg B. Ca C. Ba D. Be
Lời giải:
Đáp án: B
Ta có:
Gọi A là kí hiệu, nguyên tử khối của kim loại.
Bài 8: Điện phân nóng chảy hoàn toàn 1,9 gam muối clorua của một kim loại hóa trị II thu được 0,48 g kim loại ở catot. Xác định tên kim loại đó.
A.Sr B. C. Ba D. Mg
Lời giải:
Đáp án: D
Ta có:
Do kim loại cần tìm có hóa trị II nên công thức của muối là MCl2
Bài 9: Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoat ra 0,672 lít khí H2 (đktc). Tìm tên hai kim loại đem dùng.
A. Ca và Mg B. Ca và Sr. C. Mg và Ba D. Ba và Sr
Lời giải:
Đáp án: B
Gọi R— là kim loại hai chu kì liên tiếp của nhóm IIA.
Ta có: nH2 = 0,672/22,4 = 0,03(mol)
⇒ 2 kim loại cần tìm là: Ca và Sr.
Bài 10: Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be B. Mg C. Ca. D. Ba
Lời giải:
Đáp án: C
Gọi M là kim loại nhóm II, số mol là x
Theo đề bài ra ta có hệ phương trình:
Xem thêm các dạng bài tập Hóa học hay khác:
Lí thuyết kim loại tác dụng với HNO3 (2024) chi tiết nhất
Lí thuyết phân loại oxit (2024) chi tiết nhất
Lí thuyết về thang pH (2024) chi tiết nhất