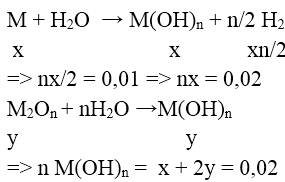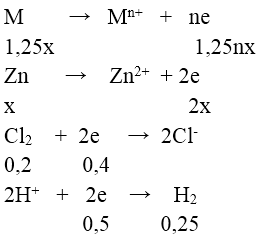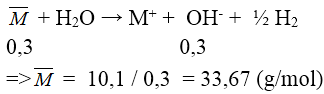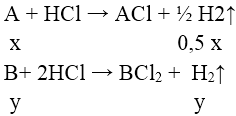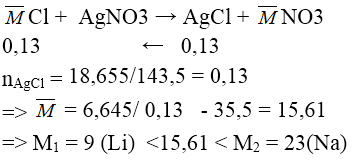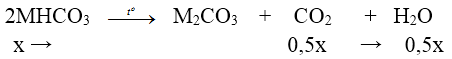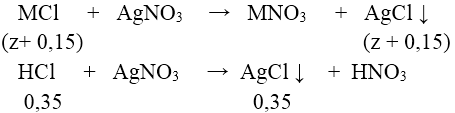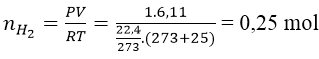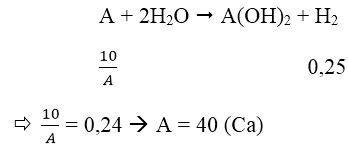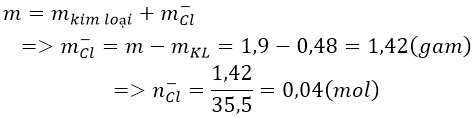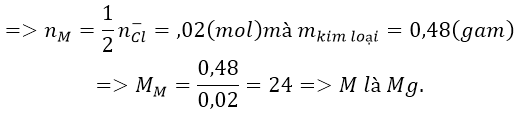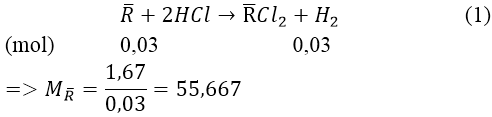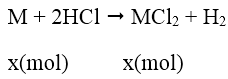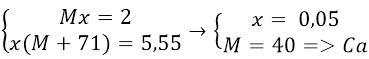Lí thuyết về Kim loại kiềm thổ
1. Lí thuyết
1.1 Vị trí, cấu tạo
Vị trí
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau kim loại kiềm.
- Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti (Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền).
Cấu tạo
1.2 Tính chất vật lí
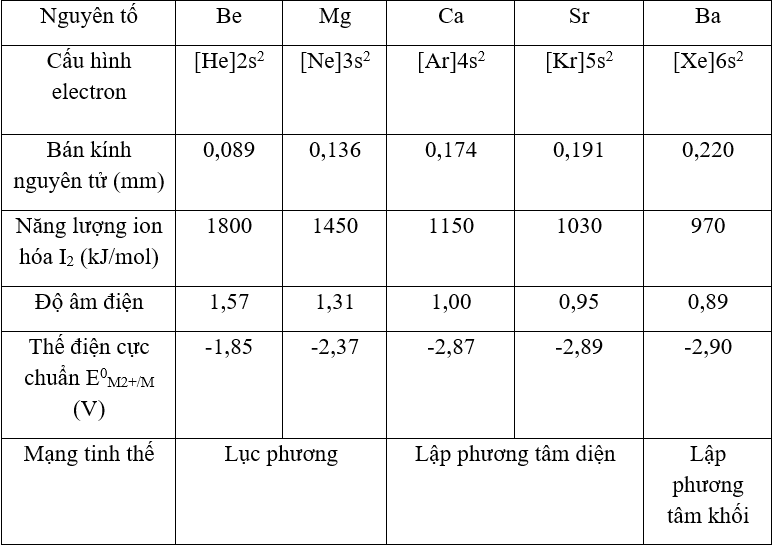
- Kim loại kiềm IIA gồm: Be: [He]2s2, Mg: [Ar]3s2, Ca: [Ar]4s2, Sr: [Kr]5s2, Ba: [Xe]6s2.
- Là những chất rắn màu trắng bạc hoặc xám nhạt, có ánh bạc, dẫn điện, dẫn nhiệt tốt.
- Nhiệt độ nóng chảy, nhiệt độ sôi tương đối thấp (cao hơn kim loại kiềm).
- Độ cứng: kim loại kiềm thổ cứng hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp; độ cứng giảm dần từ Be → Ba (Be cứng nhất có thể vạch được thủy tinh; Ba chỉ hơi cứng hơn chì).
- Khối lượng riêng tương đối nhỏ, độ cứng tuy cao hơn kim loại kiềm nhưng vẫn nhỏ hơn nhôm.
Thế điện cực chuẩn:
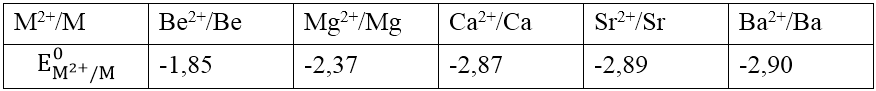
1.3 Tính chất hóa học
- Kim loại nhóm IIA là chất khử mạnh nhưng yếu hơn so với kim loại kiềm. Trong các hợp chất chúng có số oxi hóa +2.
- Tính khử tăng từ Be đến Ra:
M – 2e → M2+
Tác dụng với phi kim
- Ở to thường, Be và Mg bị oxi hóa chậm tạo thành lớp màng oxit bảo vệ, các kim loại còn lại tác dụng với mạnh hơn.
- Khi đốt nóng tất cả các kim loại nhóm IIA đều cháy thành oxit.
2M + O2 → 2MO
Ví dụ:
2Ca + O2 → 2CaO
- Với halogen: phản ứng dễ dàng ở nhiệt độ thường
M + X2 → MX2
Ví dụ:
Mg + Cl2 → MgCl2
- Với phi kim kém hoạt động phải đun nóng:
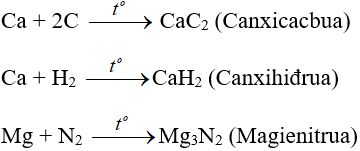
Tác dụng với nước H2O
- Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ:
Ca + 2H2O → Ca(OH)2 + H2↑
- Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
Mg + H2O → MgO + H2↑
- Be không tan trong nước dù ở nhiệt độ cao vì có lớp oxit bền bảo vệ. Nhưng Be có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo berilat:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Be + 2NaOHnóng chảy → Na2BeO2 + H2
Tác dụng với axit
- Axit không có tính oxi hóa, khử H+ thành H2
M + 2H+ → M2+ + H2↑
Ví dụ:
Ca + 2HCl → CaCl2 + H2
- Khử N+5, S+6 thành các hợp chất mức oxi hoá thấp hơn.
4M + 10HNO3 (l) → 4M(NO3)2 + 3H2O + NH4NO3
Ví dụ:
4Ca + 10HNO3 (l) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đđ → Mg(NO3)2 + 2NO2 + 2H2O
2. Bài tập vận dụng
Bài 1: Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
A. K
B. Na
C. Ba
D. Ca
Lời giải:
Đáp án: C
M: x mol ; M2On: y mol
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
Bài 2: Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là
A. Mg
B. Al
C. Ca
D. Na
Lời giải:
Đáp án: A
Bảo toàn e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M + 65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
Bài 3: Hòa tan hết 10,1 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước thu được 3 lít dung dịch có pH = 13. Hai kim loại kiềm đó là:
A. Na, K
B. Li, Na
C. K, Rb
D. Rb, Cs
Lời giải:
Đáp án: A
pH = 13 ⇒ [OH-] = 0,1M ⇒ n OH- = 0,3 mol
Bài 4: Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A. Natri , magie
B. Liti và beri
C. Liti và beri
D. Kali , bari
Lời giải:
Đáp án: A
⇒ nH2 = 0,5x + y = 0,25 ⇒ 0,25 < x + y < 0,5
⇒ 7,1/0,5 < M— < 7,1/0,25 ⇒ 14,2 < M— < 28,4
Chỉ có cặp nghiệm A = 23 (Na ) , B = 24 (Mg) thỏa mãn
Bài 5: Hòa tan hòa toàn 6,645g hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì liên tiếp nhau vào nước được dd X. Cho toàn bộ dd X tác dụng hoàn toàn với dd AgNO3 (dư), thu được 18,655g kết tủa. Hai kim loại kiềm trên là :
A. Na, K
B. Rb, Cs
C. Li , Na
D. K , Rb
Lời giải:
Đáp án: C
Bài 6: Hỗn hợp X gồm M2CO3, MHCO3, MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 gam chất rắn. Cũng đem 20,29 gam hỗn hợp X tác dụng hết với 500ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y.Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 gam kết tủa. Kim loại M là
A. Na
B. Li
C. K
D. Cs
Lời giải:
Đáp án: C
+) Nung X:
⇒ ∆m giảm = mCO2 + mH2O ⇒ 31x = 20,29 – 18,74 ⇒ x = 0,05 mol
+) X + HCl:
⇒ nCO2 = y + 0,05 = 0,15 ⇒ y = 0, 1 mol
Dung dịch Y chứa MCl và HCl dư. Gọi z là số mol MCl có trong X ta có:
⇒ nAgCl = 0,5 + z = 74,62/143,5 = 0,52 ⇒ z = 0,02
⇒(2M + 60).0,1 + (M + 61). 0,05 + (M + 35,5).0,02 = 20,29 ⇒ M = 39(K)
Bài 7: Cho 10g một kim loại kiềm thổ tác dụng với H2O, thu được 6,11 lít khí H2 (ở 25℃ và 1 atm). Hãy xác định tên của kim loại kiềm thổ đã dùng.
A. Mg B. Ca C. Ba D. Be
Lời giải:
Đáp án: B
Ta có:
Gọi A là kí hiệu, nguyên tử khối của kim loại.
Bài 8: Điện phân nóng chảy hoàn toàn 1,9 gam muối clorua của một kim loại hóa trị II thu được 0,48 g kim loại ở catot. Xác định tên kim loại đó.
A.Sr B. C. Ba D. Mg
Lời giải:
Đáp án: D
Ta có:
Do kim loại cần tìm có hóa trị II nên công thức của muối là MCl2
Bài 9: Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoat ra 0,672 lít khí H2 (đktc). Tìm tên hai kim loại đem dùng.
A. Ca và Mg B. Ca và Sr. C. Mg và Ba D. Ba và Sr
Lời giải:
Đáp án: B
Gọi R— là kim loại hai chu kì liên tiếp của nhóm IIA.
Ta có: nH2 = 0,672/22,4 = 0,03(mol)
⇒ 2 kim loại cần tìm là: Ca và Sr.
Bài 10: Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be B. Mg C. Ca. D. Ba
Lời giải:
Đáp án: C
Gọi M là kim loại nhóm II, số mol là x
Theo đề bài ra ta có hệ phương trình:
Xem thêm các dạng bài tập Hóa học hay khác:
Lí thuyết về kim loại kiềm (2024) chi tiết nhất
Lí thuyết kim loại tác dụng với HNO3 (2024) chi tiết nhất
Lí thuyết phân loại oxit (2024) chi tiết nhất