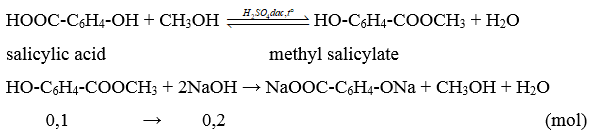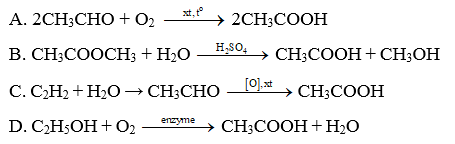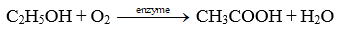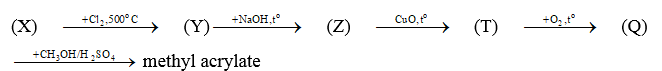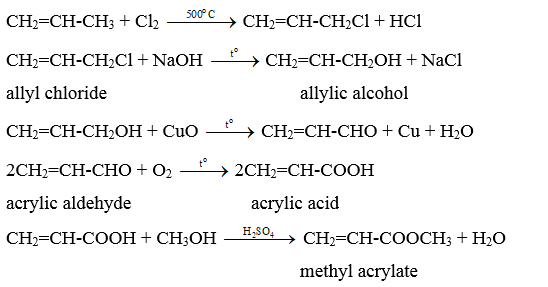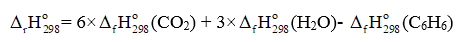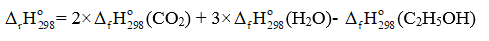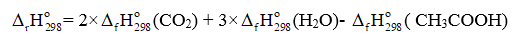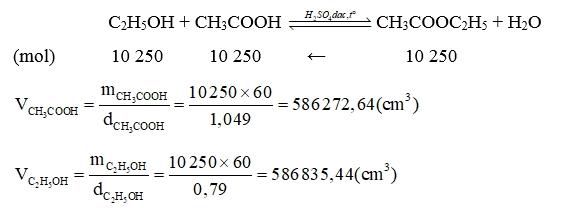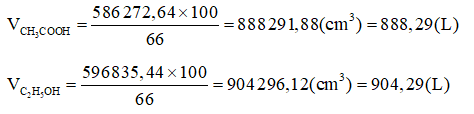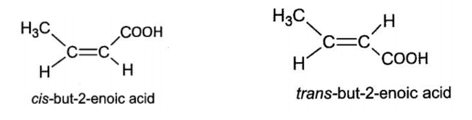Sách bài tập Hóa học 11 Bài 19: Carboxylic acid
A. CnH2nO2 (n ≥ 1). B. CnH2n+2O2 (n ≥ 1)
C. CnH2n-1COOH (n ≥ 1). D. CnH2nO2 (n ≥ 2)
Lời giải:
Đáp án đúng là: A
Công thức tổng quát của carboxylic acid no, đơn chức, mạch hở là
CnH2nO2 (n ≥ 1).
Bài 19.2 trang 96 Sách bài tập Hóa học 11: Vị chua của giấm là do chứa
A. acetic acid. B. salicylic acid.
C. oxalic acid. D. citric acid.
Lời giải:
Đáp án đúng là: A
A. CH3COOH. B. C6H5COOH.
C. HOOC-COOH. D. HCOOH.
Lời giải:
Đáp án đúng là: B
Công thức của benzoic acid là C6H5COOH.
A. (1), (2), (3), (4). B. (4), (3), (2), (1).
C. (1), (2), (4), (3). D. (1), (3), (2), (4).
Lời giải:
Đáp án đúng là: D
Khi phân tử khối của các chất chênh lệch nhau không nhiều thì nhiệt độ sôi của các chất tăng dần từ alkane < aldehyde < alcohol < carboxylic acid.
Bài 19.5 trang 96 Sách bài tập Hóa học 11: Tên gọi của CH3CH(CH3)CH2COOH là
A. 2-methylpropanoic acid. B. 2-methylbutanoic acid,
C. 3-methylbutanoic acid. D. 3-methylpropanoic acid
Lời giải:
Đáp án đúng là: C
Tên gọi của CH3CH(CH3)CH2COOH là 3-methylbutanoic acid.
A. 0,1 mol. B. 0,2 mol. C. 0,3 mol. D. 0,05 mol.
Lời giải:
Đáp án đúng là: B
Phương trình hóa học:
A. HOOC-CH2-COOH.
B. HOOC-COOH.
C. CH3-COOH.
D. HOOC-CH2-CH2-COOH.
Lời giải:
Đáp án đúng là: A
Từ đề bài, ta có: nx = 0,1 × 0,1 = 0,01 (mol).
(X) là carboxylic acid hai chức.
nmuối= 0,01 mol Mmuối= = 148
Mx= 148-23×2 + 1×2 = 104.
(X) có công thức cấu tạo là HOOC-CH2-COOH.
HOOC-CH2-COOH + 2NaOH → NaOOC-CH2-COONa + 2H2O
A. 3. B. 6. C. 4. D. 5.
Lời giải:
Đáp án đúng là: A
Chất có thể tham gia phản ứng tráng bạc là: HCHO, CH3CHO, HCOOH.
A. 10%. B. 15%. C. 18,67%. D. 20%.
Lời giải:
Đáp án đúng là: A
Gọi a là số mol CH3COOH phản ứng.
Phương trình hoá học:
CH3COOH + NaOH → CH3COONa + H2O
(mol) a → a
A. methyl acetate. B. acrylic acid.
C. propane-1,3-diol. D. acetone.
Lời giải:
Đáp án đúng là: B
(X) tác dụng được với dung dịch NaOH và dung dịch bromine, vậy (X) là acid không no. (X) là CH2=CH-COOH (acrylic acid).
A. Ethanol. B. Acetaldehyde.
C. Acetic acid. D. Phenol.
Lời giải:
Đáp án đúng là: C
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
Que diêm đang cháy cho vào miệng ống nghiệm thì que diêm tắt do có CO2 tạo thành.
Bài 19.12 trang 97 Sách bài tập Hóa học 11: Phương pháp nào sau đây được dùng để sản xuất giấm ăn?
Lời giải:
Đáp án đúng là: D
Phương pháp được dùng để sản xuất giấm ăn là
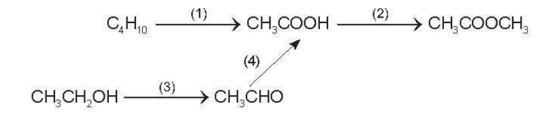
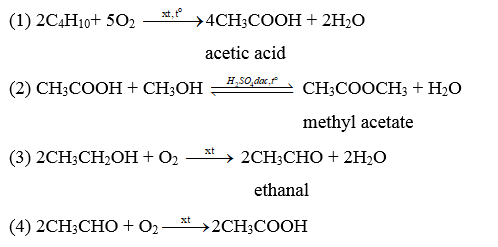
A. (X), (Y), (Z). B. (X), (Y), (T).
C. (Y), (Z), (T). D. (X), (Z), (T).
Lời giải:
Đáp án đúng là: B
CH3CH2CHO + H2 CH3CH2CH2OH
CH2=CHCHO + 2H2 CH3CH2CH2OH
CH2=CHCH2OH + H2 CH3CH2CH2OH
A. quỳ tím, dung dịch Br2 trong CCI4.
B. dung dịch Br2, dung dịch Na2CO3.
C. dung dịch Na2CO3, quỳ tím.
D. dung dịch AgNO3 trong NH3 dư, dung dịch Br2.
Lời giải:
Đáp án đúng là: D
Ban đầu, dùng dung dịch AgNO3 trong NH3 dư để nhận biết formic acid vì phản ứng sẽ sinh ra kết tủa Ag. Sau đó, dùng dung dịch Br2 để nhận biết acrylic acid vì làm mất màu dung dịch Br2. Dung dịch còn lại là acetic acid.
HCHO + 4[Ag(NH3)2]OH (NH4)2CO3 + 4Ag↓ + 6NH3 + 2H2O
CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
Bài 19.15 trang 98 Sách bài tập Hóa học 11: Cho sơ đồ phản ứng:
Lời giải:
X) là propene.
Phương trình hoá học:
Bài 19.16 trang 98 Sách bài tập Hóa học 11: Sơ đồ điều chế ethanol từ tinh bột:
Lời giải:
Phương trình hoá học:
(C6H10O5)n + nH2O nC6H12O6 (H1 = 80%)
C6H12O6 2C2H5OH + 2CO2 (H2 = 90%)
Theo phương trình: ntinhbột = 1 mol nethanol = 2 mol methanol (LT) = 92 gam
Do hiệu suất các giai đoạn là 80% và 90% nên
H = 80×90% = 72%
Khối lượng ethanol thực tế: methanol (TT) = 92 × 72% = 66,24 (g).
Thể tích dung dịch ethanol 40° là:
(b) Hoàn thành các phản ứng trong sơ đồ phản ứng trên.
Lời giải:
(a) Tên thay thế của lactic acid là 2-hydroxypropanoic acid.
(b) C12H22O11 + H2O 2C6H12O6
CH3OH[CH(OH)]4CHO 2CH3-CH(OH)-COOH
Lời giải:
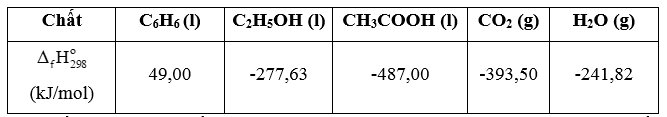
(a) Viết phương trình đốt cháy hoàn toàn C6H6, C2H5OH và CH3COOH với hệ số nguyên tối giản.
b) Chất nào trong các chất trên có biến thiên enthalpy của phản ứng lớn hơn ( âm hơn).
Lời giải:
(a) Phương trình đốt cháy hoàn toàn các chất:
2C6H6(l) + 15O2(g) 12CO2(g) + 6H2O(g) (1)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g) (2)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g) (3)
b) Biến thiên enthanpy của phản ứng:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(g)
= 6 ×(-393,5) + 3×(-241,82) - 49,00 = -3 135,46 (kJ)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g)
= 2 ×(-393,5) + 3×(-241,82) – (-277,63) = -1 234,83 (kJ)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g)
= 2 ×(-393,5) + 3×(-241,82) – (-487,00) = -783,64 (kJ)
c) Biết .
Xét khi đốt cháy cùng khối lượng là 78 gam thì
C6H6 có =-3 135,46 kJ;
C2H5OH có = -2 093,84 kJ;
CH3COOH có = -1 018,73 kJ.
Vậy khi đốt cháy cùng khối lượng thì biến thiên enthalpy của phản ứng đốt cháy các chất theo thứ tự giảm dần C6H6, C2H5OH, CH3COOH.
Lời giải:
a) Thể tích HCOOH có trong 1 con kiến:
VHCOOH = 6×10-3 ×=3,75×10-3 (cm3).
b) Phương trình hoá học của phản ứng:
HCOOH + NaHCO3 → HCOONa + CO2↑ + H2O
Theo phương trình hoá học:
Khối lượng NaHCO3 cần dùng là:
= 7,96×10-5×84 = 6,69×10-3 (g) = 6,69 (mg).
Lời giải:
vethanol = = 4 (L) = 4 000 (mL).
methanol = 0.79×4 000 = 3 160 (g).
Phản ứng lên men:
C2H5OH + O2 CH3COOH + H2O
Theo phản ứng: mgiấm ăn(LT)= 4 121,74 (g).
Với hiệu suất 80% thì khối lượng thực tế thu được:
mgiấm ăn (TT) = mgiấm ăn(LT)×80%= 4 121,74× 80% = 3 297,39 (g).
Khối lượng giấm ăn 5%:
Mdd giấm ăn 5% =
Lời giải:
Trong nọc ong có formic acid (HCOOH). Bà của An đã dùng một ít vôi bôi vào chỗ ong đốt để trung hoà acid HCOOH theo phương trình:
2HCOOH + Ca(OH)2 → (HCOO)2Ca + 2H2O
Khi formic acid được trung hoà thì vết thương đỡ bị sưng và giảm đau hơn.
Lời giải:
a) Phương trình hoá học:
C2H5OH + CH3COOH CH3COOC2H5 + H2O
b) Vai trò của cốc nước lạnh: ethyl acetate sinh ra dưới dạng hơi nên cần làm lạnh bằng nước đá để ngưng tụ.
Sau khi kết thúc phản ứng ta thêm một ít nước vào ống nghiệm, lắc nhẹ thì trong ống nghiệm có chất lỏng không màu, mùi đặc trưng, không tan trong nước và nổi trên mặt nước.
c)
Theo đề bài, hao hụt của phản ứng là 34%, do đó, hiệu suất của phản ứng là 66%.
Lời giải:
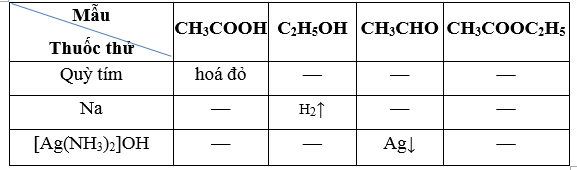
Trích mẫu thử, dùng quỳ tím thử các mẫu, chỉ có CH3COOH làm quỳ tím hoá đỏ. Các mẫu thử còn lại (C2H5OH, CH3CHO, CH3COOC2H5) không làm quỳ tím đổi màu.
Dùng Na cho tác dụng với các mẫu còn lại, chỉ có C2H5OH cho sủi bọt khí H2, các mẫu thử còn lại (CH3CHO, CH3COOC2H5) không hiện tượng.
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Hai mẫu còn lại thực hiện phản ứng tráng bạc, acetaldehyde có hiện tượng tráng bạc, ethyl acetate không có hiện tượng, mẫu còn lại là ethyl acetate.
CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag↓ + 3NH3 + H2O
Hoặc có thể trình bày dưới dạng bảng. Trích mẫu thử, sử dụng các thuốc thử, kết quả thu được ở bảng sau:
Các phương trình hoá học:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag↓ + 3NH3 + H2O
Lời giải:
Dung dịch 2% - 5% của (Y) được gọi là giấm ăn (Y) là CH3COOH.
Chọn (X), (Y), (Z) và (T) lần lượt là CH3CH2OH, CH3COOH, (CH3COO)2Ba và CH3COONa. Ta có:
(1) C2H5OH + O2 → CH3COOH + H2O
(2) 2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
(3) (CH3COO)2Ba + Na2SO4 → BaSO4↓ + 2CH3COONa
(4) CH3COONa + HCl → CH3COOH + NaCl
Chú ý: Học sinh có thể đề xuất các phản ứng khác (nếu đúng) phù hợp với sơ đồ trên.
(X) làm quỳ tím chuyển màu đỏ;
- (X) làm mất màu nước bromine;
- Khi cho tác dụng với Na2CO3 tạo chất khí không màu.
(b) Viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
a) (X) làm mất màu nước bromine nên (X) có chứa liên kết đôi trong phân tử. (X) làm quỳ tím chuyển màu đỏ, tạo chất khí không màu khi tác dụng với Na2CO3, vậy (X) là carboxylic acid.
Với công thức phân tử là C4H6O2 chứa liên kết đôi và mang nhóm chức carboxylic acid, các đồng phân có thể có của (X) là:
CH2=CH-CH2-COOH (1)
CH3CH=CH-COOH (2)
CH2=C(CH3)-COOH (3)
Trong đó (2) có đồng phân hình học (cis-, trans-).
b) Các phương trình phản ứng:
- Đối với chất CH2=CH-CH2-COOH:
CH2=CH-CH2COOH + Br2 → CH2Br-CHBr-CH2COOH
2CH2=CH-CH2COOH + Na2CO3 → 2CH2=CH-CH2COONa + CO2↑ + H2O
- Đối với chất CH3CH=CH-COOH:
CH3CH=CH-COOH + Br2 → CH3CHBr-CHBr-COOH
2CH3CH=CH-COOH + Na2CO3 → 2CH3CH=CH-COONa + CO2↑ + H2O
- Đối với chất CH2=C(CH3)-COOH:
CH2=C(CH3)-COOH + Br2 → CH2Br-CBr(CH3)-COOH
2CH2=C(CH3)-COOH + Na2CO3 → 2CH2=C(CH3)-COONa + CO2↑ + H2O
Lời giải:
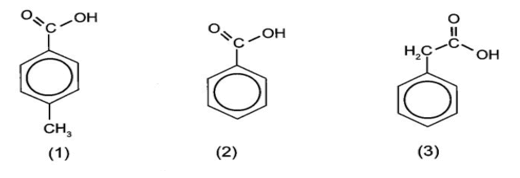
Thứ tự giảm dần tính acid: (2) > (1) > (3).
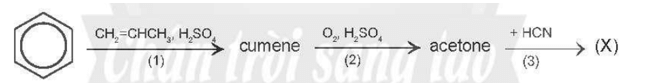
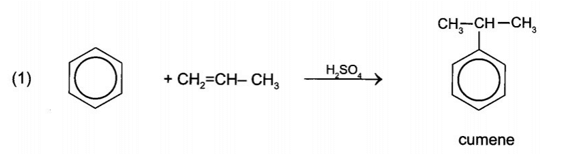
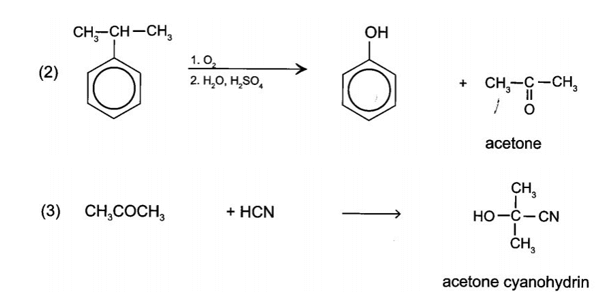
Bài 19.28 trang 101 Sách bài tập Hóa học 11: Cho sơ đồ chuyển hóa:
Hãy xác định (X), viết công thức cấu tạo các chất trong sơ đồ và hoàn thành các phản ứng.
Lời giải:
Vậy (X) là acetone cyanohydrin.
Lời giải:
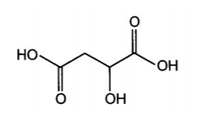
Công thức cấu tạo của malic acid (2-hydroxybutane-1,4-dioic acid) có trong táo
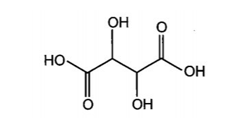
Công thức cấu tạo của tartaric acid (2,3-dihydroxybutane-1,4-dioic acid) có trong nho
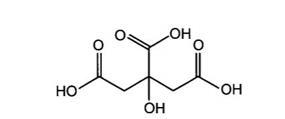
Công thức cấu tạo của citric acid (2-hydroxypropane-1,2,3-tricarboxylic acid) có trong chanh:
Lời giải:
Các hợp chất hoá học có thể thay đổi màu theo pH của dung dịch được gọi là chất chỉ thị. Một số chất chỉ thị màu tự nhiên có trong các loại thực vật, trong đó có rau muống, hoa cẩm tú cầu, bắp cải tím, ... Trong chanh có chứa 7% citric acid, vắt chanh vào nước rau muống làm thay đổi pH, do đó làm thay đổi màu nước rau. Khi chưa vắt chanh, nước rau muống có màu xanh. Khi nhỏ acid vào làm chất chỉ thị màu trong nước rau muống bị chuyển màu.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: