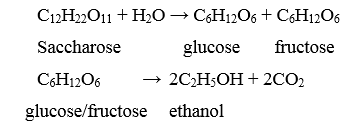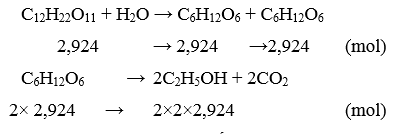Sách bài tập Hóa học 11 Bài 16: Alcohol
Bài 16.1 trang 75 Sách bài tập Hóa học 11: Alcohol no, đơn chức, mạch hở có công thức chung là
A. CnH2n+1OH (n ≥ 1).
B. CnH2n+2O (n ≥ 2).
C. CnH2nOH (n ≥ 1).
D. CnH2n-1OH (n ≥ 2).
Lời giải:
Đáp án đúng là: A
Alcohol no, đơn chức, mạch hở có công thức chung là CnH2n+1OH (n ≥ 1)
Bài 16.2 trang 75 Sách bài tập Hóa học 11: Hợp chất thuộc loại polyalcohol là
A. CH3OH.
B. CH3CH2OH.
C. CH2=CHCH2OH.
D. HOCH2CH2OH.
Lời giải:
Đáp án đúng là: D
Polyalcohol là hợp chất alcohol có nhiều nhóm chức alcol.
Vậy polyalcohol là HOCH2CH2OH.
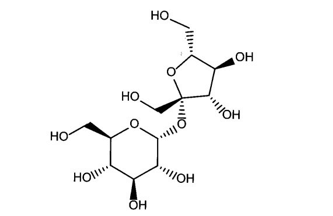
Số nhóm chức alcohol trong phân tử saccharose là
A. 3. B.5. C. 8. D. 11.
Lời giải:
Đáp án đúng là: C
Số nhóm chức alcohol trong phân tử saccharose là 8.
Bài 16.4 trang 76 Sách bài tập Hóa học 11: Ethyl alcohol có công thức cấu tạo là
A. CH3OCH3.
B. CH3CH2OH.
C. HOCH2CH2OH.
D. CH3CH2CH2OH.
Lời giải:
Đáp án đúng là: B
Ethyl alcohol có công thức cấu tạo là CH3CH2OH (alcohol no, đơn có 2 nguyên tử carbon trong phân tử)
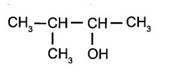
Bài 16.5 trang 76 Sách bài tập Hóa học 11: Tên của alcohol có công thức cấu tạo:
A. isobutan-2-ol.
B. 2-methylbutan-2-ol.
C. 3-methylbutan-2-ol.
D. 2-methylbutan-3-ol.
Lời giải:
Đáp án đúng là: C
Đánh số từ đầu gần nhóm OH hơn, vậy alcohol trên có tên là 3-methylbutan-2-ol.
A. CH3CH2OH.
B. HOCH2CH2OH.
C. CH3CH2CH2OH.
D. CH3CH2CH2CH2OH.
Lời giải:
Đáp án đúng là: B
Alcohol đa chức có nhiệt độ sôi cao hơn alcohol đơn chức.
Bài 16.7 trang 76 Sách bài tập Hóa học 11: Methyl alcohol, ethyl alcohol tan vô hạn trong nước là do
A. khối lượng phân tử của các alcohol nhỏ.
B. hình thành tương tác van der Waals với nước.
C. hình thành liên kết hydrogen với nước.
D. hình thành liên kết cộng hoá trị với nước.
Lời giải:
Đáp án đúng là: C
Methyl alcohol, ethyl alcohol tan vô hạn trong nước là do hình thành liên kết hydrogen với nước.
Bài 16.8 trang 76 Sách bài tập Hóa học 11: Alcohol có phản ứng đặc trưng với Cu(OH)2 là
A. propane-1,2-diol, CH3CH(OH)CH2OH.
B. propan-2-ol, CH3CH(OH)CH3.
C. propane-1,3-diol, HOCH2CH2CH2OH.
D. ethanol, CH3CH2OH.
Lời giải:
Đáp án đúng là: A
Alcohol phản ứng được với Cu(OH)2 là alcohol đa chức, có nhiều nhóm –OH liền kề.
Bài 16.9 trang 76 Sách bài tập Hóa học 11: Nhóm chức alcohol không bị phá vỡ bởi tác nhân nào?
A. Na.
B. H2SO4 đặc, 170 °C.
C. Cu.
D. CuO, to
Lời giải:
Đáp án đúng là: C
Alcohol không phản ứng với Cu.
Bài 16.10 trang 77 Sách bài tập Hóa học 11: Alcohol bị oxi hoá bởi CuO, t° tạo thành ketone là
A. CH3CH(OH)CH3.
B. CH3CH2CH2OH.
C. CH3CH2OH.
D. CH3OH.
Lời giải:
Đáp án đúng là: A
Alcohol bậc 1 bị oxi hóa thành aldehyde.
Alcohol bậc 2 bị oxi hóa thành ketone.
Alcohol bậc 3 không bị oxi hóa.
A. ≤ 0,25 mg.
B. ≤ 0,15 mg.
C. ≤ 0,10 mg.
D. > 0,25 mg.
Lời giải:
Đáp án đúng là: D
Theo Nghị định 100/2019/NĐ-CP của Chính phủ quy định, nồng độ cồn trong 1 L hơi thở ở mức > 0,25 mg là vi phạm luật khi tham gia giao thông.
Lời giải:
Đáp án đúng là: A
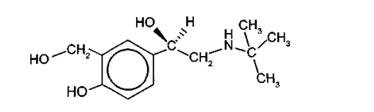
Tín hiệu đặc trưng của nhóm chức alcohol là
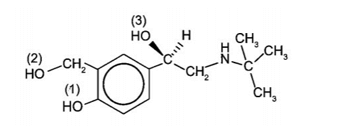
Cho biết nhóm -OH nào thuộc nhóm chức alcohol và xác định bậc alcohol trong albuterol.
Lời giải:
Albuterol có 3 nhóm -OH được kí hiệu (1), (2), (3) như hình bên dưới. Theo định nghĩa, nhóm -OH (1) không phải nhóm chức alcohol vì nhóm -OH không liên kết trực tiếp với nguyên tử carbon no (ở đây là nguyên tử carbon của vòng benzene); nhóm -OH (2) là alcohol bậc I, nhóm -OH (3) là alcohol bậc II.
Bài 16.14 trang 78 Sách bài tập Hóa học 11: Một thí nghiệm của ethanol được tiến hành như sau:
Lời giải:
Trong dung dịch, C2H5ONa phân li theo phương trình:
C2H5ONa →C2H5O- + Na+
Theo thuyết Bronsted - Lowry, ion C2H5O- bị thuỷ phân theo phương trình:
C2H5O- + H2O C2H5OH + OH-
Dung dịch có tính kiềm nên làm dung dịch phenolphthalein không màu đổi màu hồng.
Bước 2: Cho vào mỗi ống nghiệm mẩu nhỏ sodium có kích thước tương đương nhau.
Khí H2 thoát ra trong ống nghiệm nào nhanh hơn? Giải thích.
Lời giải:
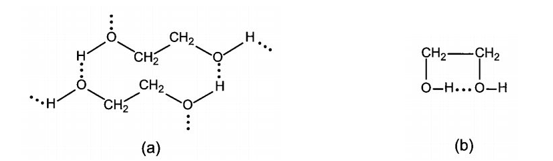
Ngoài liên kết hydrogen giữa các phân tử alcohol (Hình a), ethylene glycol còn hình thành liên kết hydrogen giữa các nhóm -OH trong phân tử (Hình b), là nguyên nhân gây ra độ nhớt của ethylene glycol, nên giảm khả năng tách nguyên tử hydrogen của nhóm -OH ra khỏi phân tử ethylene glycol. Nên khi phản ứng với sodium, hydrogen thoát ra chậm hơn so với ethyl alcohol.
Lời giải:
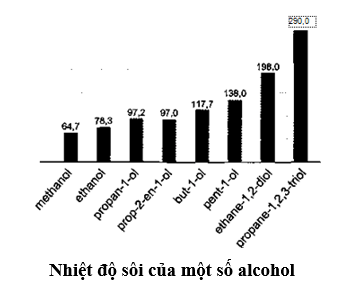
Nhiệt độ sôi của các alcohol tăng theo chiều tăng khối lượng phân tử và theo chiều tăng số lượng nhóm -OH.
Đối với các alcohol đơn chức, khi tăng khối lượng phân tử, tương tác van der Waals tăng nên nhiệt độ sôi của alcohol tăng; đối với alcohol đa chức, khi có nhiều nhóm -OH sẽ hình thành nhiều liên kết hydrogen liên phân tử hơn, nên nhiệt độ sôi của alcohol đa chức cao hơn nhiệt độ sôi của alcohol đơn chức có cùng số nguyên tử carbon.
Lời giải:
Trong gạo nếp, thành phần chủ yếu là tinh bột ((C6H10O5)n), khi ủ với men (enzyme), xảy ra các phản ứng theo phương trình hoá học sau:
(C6H10O5)n + nH2O nC6H12O6
C6H12O6 2C2H5OH + 2CO2
Cơm rượu là sản phẩm của quá trình lên men tinh bột, chứa ethanol, không qua chưng cất. Vị ngọt của sản phẩm thường do có chứa đường glucose (C6H12O6). Khi ăn nhiều món ăn này có thể gây nên sự không tỉnh táo, mệt mỏi, khó thở…
Lời giải:
Xăng E5 (hay xăng E5 RON 92, E5 A92) là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 95:5, đây là loại nhiên liệu sinh học nhằm giảm thiểu phát thải CO2 vào khí quyển được sử dụng phổ biến trên thị trường ở Việt Nam.
Xăng E10 là loại nhiên liệu phối trộn của xăng với ethanol theo tỉ lệ 90:10. Do có tỉ lệ cồn sinh học cao hơn xăng E5 và xăng A95 (không có sự phối trộn với ethanol), nên sử dụng xăng E10 sẽ thân thiện với môi trường hơn.
Lời giải:
Số mol (theo kg) của đường saccharose:
Khối lượng ethanol thu được với hiệu suất 90%:
Lời giải:
Phương trình hoá học của phản ứng:
2C2H5OH C2H5OC2H5 + H2O
Số mol của diethyl ether :
Khối lượng ethyl alcohol tối thiểu cần dùng là:
(tấn) = 1 309 (kg)
Lời giải:
LD50 của ethanol đối với người trưởng thành trong khoảng 5 gam - 8 gam trên 1 kg trọng lượng cơ thể. Lượng ethanol trung bình có thể gây tử vong cho 50% đối tượng là người trưởng thành nặng 60 kg khoảng:
5×60 = 300 (g).
Lưu ý: Đây là lượng ethanol có thể gây nguy kịch trung bình cho 50% đối tượng, có nghĩa là sẽ có lượng ethanol gây tử vong cho 1% - 100% (LD1 – LD100).
a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hơi ethanol.
b) Khi đốt cháy cùng số mol ethanol và methanol, nhiệt năng của phản ứng nào tạo ra nhiều hơn?
Lời giải:
a) Phương trình hoá học của phản ứng đốt cháy hơi ethanol:
C2H5OH(g) + 3O2(g) →2CO2(g) + 3H2O(g)
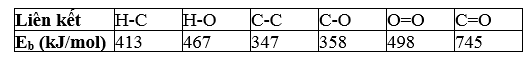
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết như sau:
= 5×Eb(C-H) + Eb(C-C) + Eb(C-O) + Eb(O-H) + 3×Eb(O=O) - 2×2×Eb(C=O) - 3×2×Eb(O-H)
= 5×413+ 347+ 358+ 467+ 3×498-4×745-6×467 = -1 051 (kJ).
b) Phương trình hoá học của phản ứng đốt cháy hơi methanol:
CH3OH(g) + O2(g) →CO2(g) + 2H2O(g)
Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết như sau :
ArH°298 = 3×Eb(C-H) + Eb(C-O) + Eb(O-H) + 1,5×Eb(O=O) - 2×Eb(C=O) - 4×Eb(O-H)
= 3×413 + 358 + 467+ 1,5×498 - 2×745 - 4×467 = -547 (kJ).
Vậy khi đốt cháy cùng số mol methanol và ethanol thì ethanol giải phóng nhiệt năng lớn hơn.
Bài 16.23 trang 81 Sách bài tập Hóa học 11: Hoạt động trải nghiệm.
Bước 1: Đong 100 mL (tương đương 100 gam) nước cất, cho vào bình tam giác. Đo nhiệt độ (t) của nước.
Bước 2: Rót 20 mL mỗi alcohol cho riêng biệt vào 4 đèn cồn. Cân khối lượng mỗi đèn (m1).
a) Khi đốt cháy 1 mol mỗi alcohol trên, alcohol nào tạo ra năng lượng lớn nhất?
b) So sánh năng lượng tạo ra khi đốt cháy hoàn toàn cùng một khối lượng propan-1-ol và propan-2-ol.
c) Xét trường hợp của ethanol, so sánh với năng lượng tính toán lí thuyết:
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g) ∆rH°298 = -1 234,83 kJ
Nhiệt lượng nước nhận được: Q = 100×4,18×(40 -t) (J).
Có phải tất cả nhiệt lượng do quá trình đốt cháy alcohol đều làm tăng nhiệt độ của nước không?
Lời giải:
a) Tính khối lượng mỗi alcohol phản ứng: malcohol = m2 – m1, lần lượt được các giá trị mal1, mal2, mal3, mal4.
Cùng điều kiện tiến hành thí nghiệm, cùng khối lượng nước, cùng sự biến thiên nhiệt độ từ t đến 40 °C (bỏ qua sai số về khối lượng giữa các bấc đèn khi cháy). Alcohol nào có khối lượng (m) nhỏ hơn thì toả ra nhiệt lượng lớn hơn.
b) So sánh giá trị mal2 và mal3.
c) Xét trường hợp của ethanol, nhiệt lượng nước nhận được tư mal1 (gam) ethanol:
Q = 100×4,18×(40 -t) (đơn vị: J)
Số mol ethanol phản ứng:
Nhiệt lượng nước nhận được từ 1 mol ethanol là: .
Enthalpy của quá trình đốt cháy ethanol là: AH = -Qethanol
(Giá trị này sẽ thấp hơn so với giá trị lí thuyết).
Khi đốt cháy alcohol, nhiệt lượng toả ra sẽ hao phí, một phần truyền vào môi trường, truyền cho bình tam giác, các nhóm thực hiện có thể xảy ra sai số,…
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: