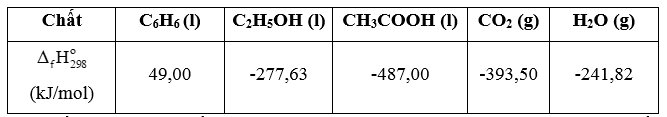
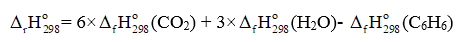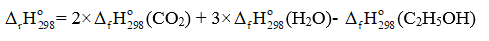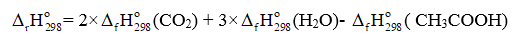Cho enthalpy tạo thành tiêu chuẩn của các chất trong bảng sau. (a) Viết phương trình đốt cháy hoàn toàn
134
16/11/2023
Bài 19.19 trang 99 Sách bài tập Hóa học 11: Cho enthalpy tạo thành tiêu chuẩn của các chất trong bảng sau.
(a) Viết phương trình đốt cháy hoàn toàn C6H6, C2H5OH và CH3COOH với hệ số nguyên tối giản.
b) Chất nào trong các chất trên có biến thiên enthalpy của phản ứng lớn hơn ( âm hơn).
c) Từ kết quả tính toán hãy so sánh biến thiên enthalpy của phản ứng khi đốt cháy cùng khối lượng C6H6, C2H5OH và CH3COOH.
Trả lời
(a) Phương trình đốt cháy hoàn toàn các chất:
2C6H6(l) + 15O2(g) 12CO2(g) + 6H2O(g) (1)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g) (2)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g) (3)
b) Biến thiên enthanpy của phản ứng:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(g)
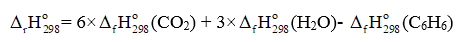
= 6 ×(-393,5) + 3×(-241,82) - 49,00 = -3 135,46 (kJ)
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g)
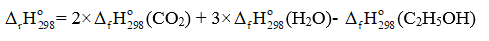
= 2 ×(-393,5) + 3×(-241,82) – (-277,63) = -1 234,83 (kJ)
CH3COOH(l) + 2O2 2CO2(g) + 3H2O(g)
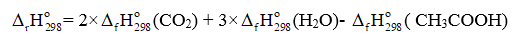
= 2 ×(-393,5) + 3×(-241,82) – (-487,00) = -783,64 (kJ)
c) Biết .
Xét khi đốt cháy cùng khối lượng là 78 gam thì
C6H6 có =-3 135,46 kJ;
C2H5OH có = -2 093,84 kJ;
CH3COOH có = -1 018,73 kJ.
Vậy khi đốt cháy cùng khối lượng thì biến thiên enthalpy của phản ứng đốt cháy các chất theo thứ tự giảm dần C6H6, C2H5OH, CH3COOH.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác: