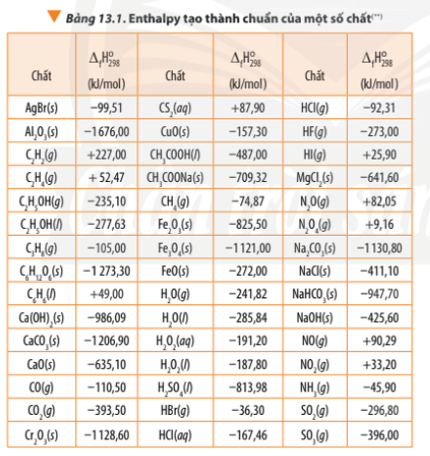
Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Bài 3 trang 93 Hóa học 10: Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) →t° 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị ∆ r đối với phản ứng.