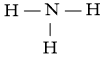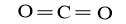Giải Hoá Học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Lời giải:
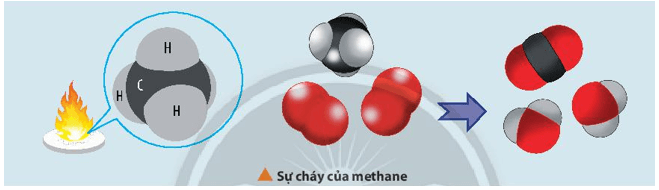
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
Biến thiên enthalpy của phản ứng cháy của methane có thể được tính theo hai cách:
- Cách 1: Dựa vào nhiệt tạo thành chuẩn của các chất.
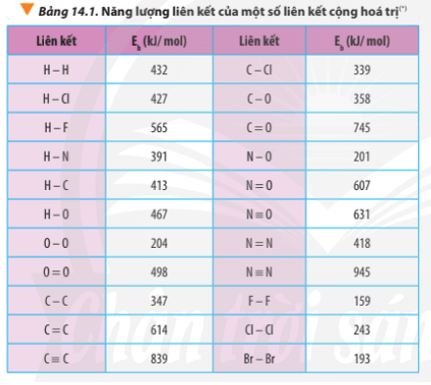
∆r = ∆f(CO2) + 2.∆f(H2O) – ∆f(CH4) – 2.∆f(O2)
- Cách 2: Dựa vào năng lượng liên kết của các chất.
∆r = Eb(CH4) + 2.Eb(O2) – Eb(CO2) – 2.Eb(H2O)
∆r = 4.Eb(C-H) + 2.Eb(O=O) – 2. Eb(C=O) – 2.2.Eb(O-H)
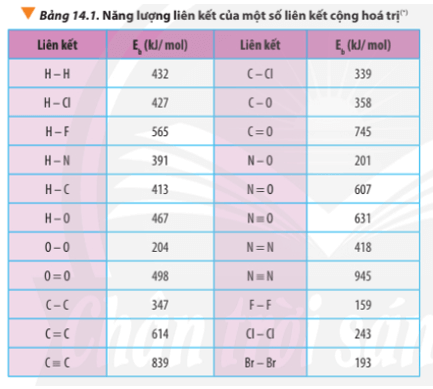
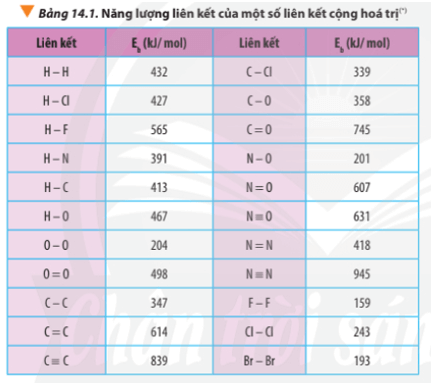
1. Xác định biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết
Lời giải:
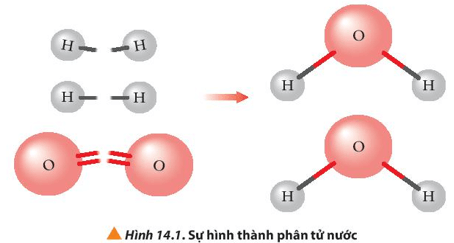
Khi H2 phản ứng với O2 tạo thành H2O (ở thể khí) liên kết H-H và O=O bị đứt ra, liên kết O-H được hình thành.
Lời giải:
|
Phân tử |
Công thức cấu tạo |
Số lượng mỗi loại liên kết |
|
|
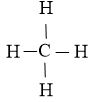
CH4 |
|
4 liên kết C-H |
|
|
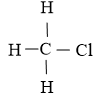
CH3Cl |
|
3 liên kết C-H 1 liên kết C-Cl |
|
|
NH3 |
|
3 liên kết N-H |
|
|
CO2 |
(cau-hoi-2-trang-89-hoa-hoc-10-3) |
|
2 liên kết C=O |
Lời giải:
N2(g) + O2(g) 2NO(g)
∆ r = Eb(N2) + Eb(O2) – 2Eb(NO)
∆ r = Eb(N≡N) + Eb(O=O) – 2Eb(N=O)
∆ r = 945 + 498 – 2.607 = 229 kJ
Ta thấy để phá vỡ 1 liên kết N≡N và 1 liên kết O=O để hình thành 2 liên kết N-O cần cung cấp nhiệt lượng lớn (229 kJ).
⇒ Cần thực hiện ở nhiệt độ cao hoặc có tia lửa điện thì phản ứng mới xảy ra.
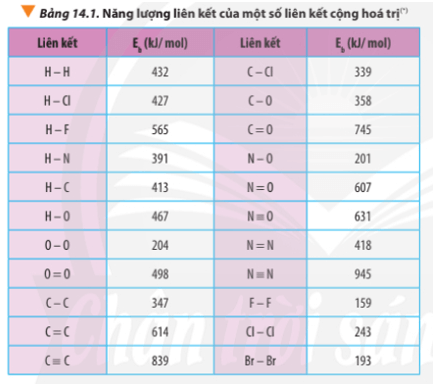
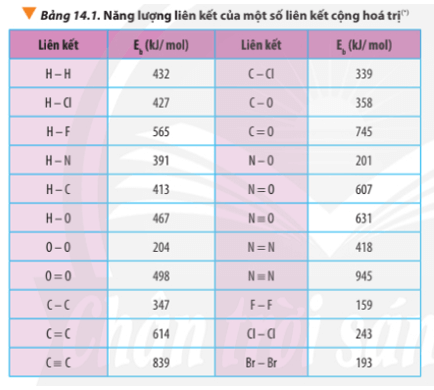
Luyện tập trang 89 Hóa học 10: Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Lời giải:
∆ r = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl)
∆ r = 4.Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) – Eb(C-Cl) – Eb(H-Cl)
∆ r = 4.413 + 243 – 3.413 – 339 – 427
∆ r = -110 kJ < 0
⇒Phản ứng tỏa nhiệt.
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
Lời giải:
2H2(g) + O2(g) 2H2O(g) (1)
∆ r(1) = 2.Eb(H2) + Eb(O2) – 2.Eb(H2O)
∆ r(1) = 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H)
∆ r(1) = 2.432 + 498 – 2.2.467 = -506 kJ
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
∆ r(2) = Eb(C7H16) + 11.Eb(O2) – 7.Eb(CO2) – 8.Eb(H2O)
∆ r(2) = 6.Eb(C-C) + 16Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
∆ r(2) = 6.347 + 16.413 + 11.498 – 7.2.745 – 8.2.467 = -3734 kJ
Ta thấy: ∆ r(2) < ∆ r(1) ⇒ Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1)
⇒ C7H16 là nhiên liệu hiệu quả hơn cho tên lửa.
Luyện tập trang 90 Hóa học 10: Tính ∆ r của hai phản ứng sau:
Lời giải:
3O2(g) → 2O3(g) (1)
∆ r(1) = 3.Eb(O2) – 2.Eb(O3)
∆ r(1) = 3.Eb(O=O) – 2.[Eb(O-O) + Eb(O=O)]
∆ r(1) = 3.498 – 2.(204 + 498) = 90 kJ
2O3(g) → 3O2(g) (2)
∆ r(2) = 2.Eb(O3) - 3.Eb(O2)
∆ r(2) = 2.[Eb(O-O) + Eb(O=O)] - 3.Eb(O=O)
∆ r(2) = 2.(204 + 498) - 3.498 = -90 kJ
⇒Phản ứng (2) xảy ra thuận lợi hơn
Bên cạnh đó O3 kém bền hơn O2
⇒∆ r càng âm, chất tạo ra càng bền hơn.
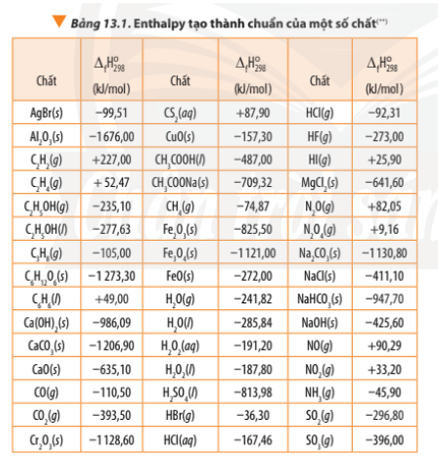
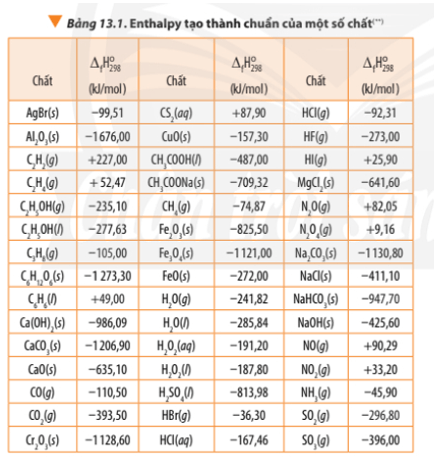
2. Xác định biến thiên Enthalpy của phản ứng dựa vào Enthalpy tạo thành
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Lời giải:
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
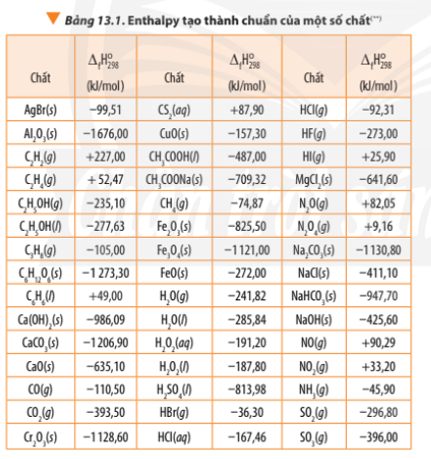
∆ r = 6.∆ f(N2) + 12. ∆ f(CO2) + 10. ∆ f(H2O) + ∆ f(O2) – 4. ∆ f(C3H5O3(NO2)3)
∆ r = 6.0 + 12.(-393,50) + 10.(-241,82) + 0 – 4.(-370,15) = -5659,6 kJ < 0
⇒ Phản ứng tỏa lượng nhiệt rất lớn và có khả năng sát thương cao.
⇒ Trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Lời giải:
- Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học.
Khi tính giá trị biến thiên enthalpy của phản ứng thì cần nhân hệ số tỉ lượng với enthalpy tạo thành của các chất tương ứng.
- Giá trị enthalpy tạo thành thường được đo ở điều kiện chuẩn: Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K)
CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) (2)
Lời giải:
CS2(l) + 3O2(g) CO2(g) + 2SO2(g) (1)
∆ r(1) = 1.∆ f(CO2) + 2.∆ f(SO2) - 1.∆ f(CS2) – 3.∆ f(O2)
∆ r(1) = -393,50 + 2.(-296,80) – 1.87,90 – 3.0 = -1075 kJ
4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) (2)
∆ r(2) = 2.∆ f(N2) + 6.∆ f(H2O) - 4.∆ f(NH3) – 3.∆ f(O2)
∆ r(2) = 2.0 + 6.(-241,82) – 4.(-45,9) – 3.0 = -1267,32 kJ
Bài tập (trang 92, 93)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
Lời giải:
a) N2H4(g) → N2(g) + 2H2(g)
∆ r = Eb(N2H4) – Eb(N2) – 2.Eb(H2)
∆ r = Eb(N-N) + 4.Eb(N-H) – Eb(N≡N) – 2.Eb(H-H)
∆ r = 163 + 4.391 – 945 – 2.432 = -82 kJ
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)
∆ r = 4.Eb(HCl) + Eb(O2) – 2Eb(Cl2) – 2Eb(H2O)
∆ r = 4.Eb(H-Cl) + Eb(O=O) – 2.Eb(Cl-Cl) – 2.2.Eb(O-H)
∆ r = 4.427 + 498 -2.243 – 2.2.467 = -148 kJ
Lời giải:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ
1,0 gam C6H6(l) ứng với mol C6H6(l)
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-285,84) – (-105,00) - 5.0
∆ r = -2218,86 kJ
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị ∆ r đối với phản ứng.
Lời giải:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
∆ r = 2.∆ f(Fe) + ∆ f(Al2O3) – 2. ∆ f(Al) - ∆ f(Fe2O3)
∆ r = 2.0 + (-1676,00) – 2.0 – (-825,5)
∆ r = -850,5 kJ < 0
⇒ Phản ứng nhiệt nhôm sinh ra một lượng nhiệt rất lớn.
Bài 4 trang 93 Hóa học 10: Cho phương trình nhiệt hóa học sau:
SO2(g) + O2(g) SO3(g) ∆ r = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là bao nhiêu?
Lời giải:
a) 74,6 g SO2 tương ứng với mol SO2
Đốt cháy hoàn toàn 1 mol SO2(g) sinh ra 98,5 kJ nhiệt lượng
⇒ Đốt cháy hoàn toàn mol SO2(g) sinh ra 98,5. = 114,81 kJ nhiệt lượng
b) Lượng nhiệt giải phóng ra khi chuyển 1 mol SO2 thành 1 mol SO3 là 98,5 kJ
⇒ Lượng nhiệt cần cung cấp để phân hủy 1 mol SO3 cũng là 98,5 kJ
⇒ Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là +98,5 kJ.
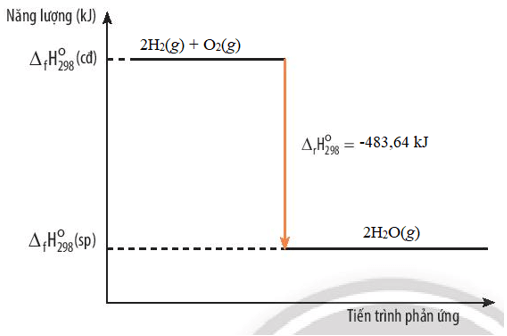
2H2(g) + O2(g) → 2H2O(g) ∆ r = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Lời giải:
a) ∆ r = Σ∆ f(sp) - Σ ∆ f(cđ) < 0
⇔ Σ∆ f(sp) < Σ ∆ f(cđ)
Vậy hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn nước.
b) Sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Bài 6 trang 93 Hóa học 10: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Lời giải:
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
Tính theo nhiệt tạo thành của hợp chất:
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-241,82) – (-105,00) - 5.0
∆ r = -2042,78 kJ
Tính theo năng lượng liên kết:
∆ r = Eb(C3H8) + 5.Eb(O2) – 3Eb(CO2) – 4Eb(H2O)
∆ r = 2.Eb(C-C) + 8.Eb(C-H) + 5.Eb(O=O) -3.2.Eb(C=O) - 4.2.Eb(O-H)
∆ r = 2.347 + 8.413 + 5.498 – 3.2.745 – 4.2.467
∆ r = -1718 kJ
Hai giá trị tính được gần bằng nhau.
Xem thêm lời giải bài tập SGK Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA