Lí thuyết về tính chất hóa học của Sắt (Fe)
I. Lí thuyết
1. Vị trí và cấu tạo
- Fe: Z = 26 1s22s22p63s23p63d64s2
=> Sắt nằm ở chu kì 4, nhóm VIIIB, ô số 26.
- Là kim loại chuyển tiếp, có xu hướng nhường 2, 3 electron khi tham gia phản ứng hóa học
- Sắt có 2 kiểu mạng tinh thể là lập phương tâm diện và lập phương tâm khối
2. Tính chất vật lí
- Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, có D = 7,9 g/cm3.
- Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
3. Tính chất hóa học
3.1. Tác dụng với phi kim
Fe + S FeS
3Fe + 2O2 Fe3O4
2Fe + 3Cl2 2FeCl3
3.2. Tác dụng với axit
- Fe + axit HCl, H2SO4 loãng → muối + H2
Fe + H2SO4 → FeSO4 + H2
- Fe + axit có tính OXH mạnh → muối + sản phẩm khử + H2O
Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO
2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
=> Fe thụ động trong HNO3 đặc nguội, H2SO4 đặc nguội.
3.3. Tác dụng với dung dịch muối
Fe tác dụng với dung dịch muối của kim loại yếu hơn nó (kim loại đứng sau nó trong dãy hoạt động hóa học)
Fe + CuSO4 → FeSO4 + Cu
Fe + 3AgNO3 (dư) → Fe(NO3)3 + 3Ag
3.4. Tác dụng với nước
Ở nhiệt độ cao, sắt khử được hơi nước :
3Fe + 4H2O Fe3O4 + 4H2
Fe + H2O FeO + H2
4. Trạng thái tự nhiên
- Sắt là nguyên tố phổ biến thứ 2 trong vỏ trái đất (sau nhôm).
- Một số quặng sắt quan trọng: Quặng hematit đỏ chứa Fe2O3 khan. Quặng hematit nâu chứa Fe2O3.nH2O. Quặng manhetit chứa Fe3O4 , quặng xiđerit chứa FeCO3, quặng pirit sắt chứa FeS2.
- Sắt còn có mặt trong hồng cầu của máu.
II. Bài tập vận dụng
Câu 1: Hòa tan hoàn toàn 10 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 5,6 lít H2 (đktc) và dung dịch D. Để kết tủa hoàn toàn các ion trong D cần 300 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,12 lít.
C. 0,15 lít.
D. 0,2 lít.
Hướng dẫn giải chi tiết:
Ta có sơ đồ phản ứng như sau:
Áp dụng định luật bảo toàn nguyên tố Natri
n NaCl = nNaOH = 0,6 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> n HCl = n NaCl = 0,6 (mol)
V HCl = 0,6 : 4 = 0,15 lít
Đáp án C.
Câu 2: Để hoà tan hoàn toàn 23,2 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 0,5M. Giá trị của V là :
A. 1,8.
B. 0,8.
C. 2,3.
D. 1,6.
Hướng dẫn giải chi tiết:
Vì số mol của FeO và Fe2O3 trong hỗn hợp bằng nhau nên ta quy đổi hỗn hợp FeO, Fe3O4 và Fe2O3 thành Fe3O4.
Ta có = = 0,1 mol.
n HCl = 2 . n O (trong oxit) = 2 . 0,1 .4 = 0,8 (mol)
=> V HCl = 0,8 : 0,5 = 1,6 lít
Đáp án D
Câu 3: Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có VX = 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là :
A. 25% và 75% ; 1,12 gam.
B. 25% và 75% ; 11,2 gam.
C. 35% và 65% ; 11,2 gam.
D. 45% và 55% ; 1,12 gam.
Hướng dẫn giải chi tiết:
Gọi số mol của NO2, NO lần lượt là x, y.
n Hỗn hợp khí = 8,96 : 22,4 = 0,4 (mol)
=> x + y = 0,4 (I)
Khối lượng mol trung bình của hỗn hợp khí là:
1,3125 . 32 = 42 (gam/mol)
=> Khối lượng của hỗn hợp khí trên là: 42 . 0,4 = 16,8 (gam)
=> 46x + 30y = 16,8 (II)
Từ (I) và (II) => x = 0,3 ; y = 0,1
=> % NO2 = 0,3 : (0,3 + 0,1) . 100% = 75%
% NO = 25%
Áp dụng đinh luật bảo toàn electron ta có:
3 . n Fe = 1 . n NO2 + 3 . n NO
=> 3 . n Fe = 0,3 + 3 . 0,1 = 0,6
=> n Fe = 0,6 : 3 = 0,2 mol
=> m Fe = 0,2 .56 = 11,2 gam
Đáp án B
Câu 4: Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khí NO2 duy nhất (đktc). Nồng độ % các chất có trong dung dịch A là :
A. 36,66% và 28,48%.
B. 27,19% và 21,12%.
C. 27,19% và 72,81%.
D. 78,88% và 21,12%.
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn nguyên tố Nito
=> n HNO3 = n NO3 + n NO2
Do n NO3 = n e trao đổi = n NO2
=> n HNO3 = 1 mol
m HNO3 = 1 . 63 = 63 gam
=> m dd HNO3 = 63 : C% = 63 : 63 . 100 = 100 (gam)
Áp dụng định luật bảo toàn khối lượng ta có:
m dung dịch muối = m hỗn hợp kim loại + m dd HNO3 – m NO2
= 12 + 100 – 0,5 .46 = 89 (gam)
Gọi số mol của Fe, Cu lần lượt là x, y mol
Ta có hệ phương trình như sau:
=> x = 0,1 ; y = 0,1
m Fe(NO3)3 = 0,1 . (56 + 62.3) = 24,2 (gam)
m Cu(NO3)2 = 0,1 . (64 + 62.2) = 18,8 (gam)
% m Fe(NO3)3 = 24,2 : 89 . 100% = 27,19%
% m Cu(NO3)2 = 18,8 : 89 . 100% = 21,1%
Câu 5: Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 63 gam HNO3, thu được 1,568 lít NO2 (đktc). Dung dịch thu được cho tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi thu được 9,76 gam chất rắn X. Nồng độ % của dung dịch HNO3 có giá trị là :
A. 47,2%.
B. 46,2%.
C. 46,6%.
D. 44,2%.
Hướng dẫn giải chi tiết:
Chất rắn X là Fe2O3
=> n Fe2O3 = 9,76 : 160 = 0,061 mol
Áp dụng định luật bảo toàn nguyên tố Fe
=> n Fe(OH)3 = 2 . n Fe2O3 = 0,061 . 2 = 0,122 mol
Gọi số mol của Fe3O4, FeS2 lần lượt là x, y (mol)
Áp dụng định luật bảo toàn nguyên tố Fe
=> 3 . n Fe3O4 + n FeS2 = n Fe(OH)3
=> 3x + y = 0,122 (I)
Áp dụng định luật bảo toàn electron
=> n Fe3O4 + 15 . n FeS2 = n NO2
=> x + 15y = 0,07 (II)
Từ (I) và (II) => x = 0,04; y = 0,002
Áp dụng định luật bảo toàn nguyên tố Na
=> n NaOH = n NaNO3 + 2 . n Na2SO4 (1)
n Na2SO4 = 2 . nFeS2 = 0,002 . 2 = 0,004 mol (2)
=> n NaNO3 = 0,04 – 0,004 . 2 = 0,392 (mol)
Áp dụng định luật bảo toàn nguyên tố N là:
n HNO3 = n NaNO3 + n NO2 = 0,392 + 0,07 = 0,462 (mol)
=> C% HNO3 = (0,462 . 63) : 63 . 100% = 46,2%
Đáp án B
Câu 6: Cho thanh sắt Fe vào dung dịch X chứa 0,15 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 12,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
Hướng dẫn giải chi tiết:
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1
=> mtăng = 0,15.108 – 0,075.56 = 12 < 12,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
=> mtăng = 64x – 56x = 8x
+) tổng khối lượng tăng ở 2 phản ứng là:
mtăng = 12 + 8x = 12,8 => x = 0,1 mol
=> mkim loại bám vào = mAg+ mCu = 22,6 gam
Câu 7: Cho 8,4 gam bột sắt vào 100 ml dung dịch gồm AgNO3 2M và Cu(NO3)2 1M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
Hướng dẫn giải chi tiết:
nFe = 0,15 mol; nAgNO3 = 0,2mol; nCu(NO3)2 = 0,1 mol
Nhận xét: 2nFe > nAg
=> không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+
=> Fe tạo muối Fe2+
ne Fe cho tối đa = 0,15.2 = 0,3 mol
ne Ag+ nhận tối đa = 0,2 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,2 < ne Fe cho tối đa< 0,2 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
=> ne Cu2+ nhận tạo Cu = 0,3 – 0,2 = 0,1 mol => nCu = 0,05 mol
=> m = mAg + mCu = 0,2.108 + 0,05.64 = 24,8 gam.
Câu 8: Cho a gam Fe tác dụng với dung dịch HNO3 thu được 2,24 lít khí NO (sản phẩm khử duy nhất, ở đktc), dung dịch X và còn dư 5,6 gam Fe. Cô cạn X thu được b gam muối khan. Giá trị của a, b lần lượt là
A. 14,0; 27,0.
B. 8,4; 27,0.
C. 14,0; 36,3.
D. 11,2; 27,0.
Hướng dẫn giải chi tiết:
Do sau phản ứng còn dư Fe nên muối thu được là muối sắt (II)
Quá trình cho nhận electron:
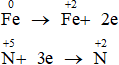
Bảo toàn electron: 2nFe phản ứng = 3nNO
Ta có: a = mFe phản ứng + mFe dư = 0,15.56 + 5,6 = 14 gam
Bảo toàn nguyên tố:
Chọn A.
Câu 9: Cho a gam Fe vào 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và Cu(NO3)2 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92a gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
A. 8,4.
B. 11,0.
C. 11,2.
D. 5,6.
Hướng dẫn giải chi tiết:
Gọi số mol của Fe phản ứng là x mol
Quá trình cho nhận electron:
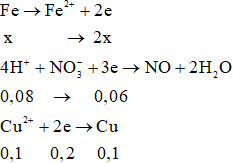
Bảo toàn electron: 2x = 0,06 + 0,2
→ x = 0,13
Ta có: mgiảm = a – 0,92a = 0,08a gam
Lại có mgiảm = mFe phản ứng – mCu = 0,13.56 – 0,1.64 = 0,88 gam
→ 0,08a = 0,88
→ a = 11
Chọn B.
Câu 10: Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có thể tích 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là
A. 25% và 75%; 1,12 gam.
B. 25% và 75%; 11,2 gam.
C. 35% và 65%; 11,2 gam.
D. 45% và 55%; 1,12 gam.
Hướng dẫn giải chi tiết:
Đặt số mol của NO2 và NO là x và y
Áp dụng định luật bảo toàn electron cho các chất khử và oxi hóa ta có:
Chọn B.
Xem thêm các dạng bài tập Hóa học hay khác:
Lí thuyết về Tinh bột (2024) chi tiết nhất
Lí thuyết về Saccarozơ (2024) chi tiết nhất
Lí thuyết về Hiđroxit lưỡng tính (2024) chi tiết nhất
Lí thuyết về Hiệu suất phản ứng (2024) chi tiết nhất
Lí thuyết về Peptit (2024) chi tiết nhất