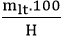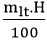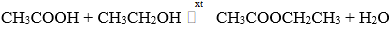Lí thuyết về Hiệu suất phản ứng
I. Lí thuyết
H = 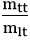
Trong đó:
+ mtt: khối lượng thực tế
+ mlt: khối lượng tính theo lý thuyết
+ H: hiệu suất
- Công thức tính khối lượng chất tham gia khi có hiệu suất
mtt =
- Công thức tính khối lượng sản phẩm khi có hiệu suất
mtt =
II. Bài tập vận dụng
Câu 1: Cho luồng khí H2 đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao. Sau phản ứng thu được 16,8 gam chất rắn. Hiệu suất của phản ứng là
Biết phương trình hóa học của phản ứng như sau:
CuO + H2 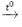
A. 70%
B. 75%
C. 80%
D. 85%
Lời giải:
Chọn C
Gọi a là số mol CuO phản ứng:
CuO + H2 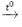
a ... a ... a ... a ... mol
Ta có nCuO bđ = 20 : 80 = 0,25 mol
→ nCuO dư = 0,25 – a mol
Theo đề bài, ta có:
mchất rắn = mCu + mCuO dư hay 16,8 = 64a + 80.(0,25 – a)
→ a = 0,2 mol; mCuO pư = 0,2.80 = 16 gam.
Vậy hiệu suất phản ứng: H = 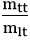
Câu 2: Trộn 10,8 g bột nhôm với bột lưu huỳnh dư. Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 g Al2S3. Tính hiệu suất phản ứng ?
A. 85%
B. 80%
C. 90%
D. 92%
Lời giải:
Đáp án A
nAl = 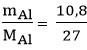
Phương trình hóa học:
2Al + 3S 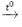
2 → 1 mol
0,4 → 0,2 (mol)
mAl2S3 lt = 0,2.150 = 30 g
Hiệu suất phản ứng là: H = 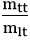
Câu 3: Một cơ sở sản xuất vôi tiến hành nung 4 tấn đá vôi (CaCO3) thì thu được 1,68 tấn vôi sống(CaO) và một lượng khí CO2. Tính hiệu suất của quá trình nung vôi.
A. 70%
B. 75%
C. 80%
D. 85%
Lời giải:
Đáp án B
Phương trình hóa học:
CaCO3 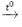
1 mol → 1 mol
100 g → 56 g
Theo bài: 4 tấn → m tấn
Khối lượng CaO thu được theo lý thuyết: mCaO lt = 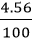
Hiệu suất phản ứng là: H = 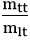
Câu 4: Cho 22,4 lít khí etilen C2H4 (đktc) tác dụng với nước (dư) có axit sunfuric làm xúc tác, thu được 13,8 gam rược etylic C2H5OH. Tính hiệu suất phản ứng cộng nước của etilen.
A. 20%
B. 25%
C. 30%
D. 30,2%
Lời giải:
Đáp án C
nC2H4 = 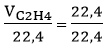
Phương trình hóa học:
C2H4 + H2O 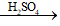
1 mol → 1 mol
Theo lý thuyết khối lượng rược etylic thu được: mC2H5OH lt = 1.46 = 46 g
Hiệu suất phản ứng là: H = 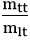
Câu 5: Điều chế khí oxi bằng cách nhiệt phân 1 mol KClO3 thì thu được 43,2 g khí oxi và một lượng kali clorua (KCl). Tính hiệu suất phản ứng?
A. 85%
B. 90%
C. 95%
D. 98%
Lời giải:
Đáp án B
Phương trình hóa học:
2KClO3 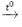
1 → 1,5 (mol)
Theo phương trình: nO2 lt = 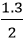
Khối lượng oxi thu được theo lý thuyết là: mO2 lt = 1,5.32 = 48 g
Hiệu suất phản ứng là: H = 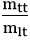
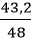
Câu 6: Để điều chế được 8,775 gam muối natri clorua (NaCl) thì cần bao nhiêu gam Na? Biết hiệu suất phản ứng đạt 75%.
A. 2,3 gam.
B. 4,6 gam.
C. 3,2 gam.
D. 6,4 gam.
Lời giải:
Chọn B
Ta có: nNaCl = 8,775 : 58,5 = 0,15 mol
Phương trình hóa học:
2Na + Cl2 → 2NaCl
0,15 ← 0,15 mol
Khối lượng Na theo lý thuyết là: mNa lt = 0,15 .23 = 3,45 gam.
Do H = 75% nên khối lượng Na cần dùng là:
mNa tt = 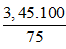
Câu 7: Tính thể tích C2H4 (đktc) cần để điều chế được 6,9 gam rượu etylic. Biết hiệu suất phản ứng là 75%. Phản ứng theo sơ đồ: C2H4 + H2O C2H5OH.
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Lời giải:
Đáp án C
nC2H5OH = 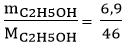
Phương trình hóa học:
C2H4 + H2O 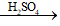
1 ← 1 mol
0,15 ← 0,15 (mol)
Theo phương trình: nC2H4 = 0,15 mol
Do H = 75% nên nC2H4 tt = 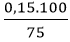
VC2H4 tt = 0,2.22,4 = 4,48 lít
Câu 8: Cho 13,6 gam hỗn hợp X gồm axit axetic (CH3COOH) và rượu etylic (C2H5OH) được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 80%. Giá trị của m là
Biết phản ứng hóa học xảy ra như sau:
A. 7,04g.
B. 8,80g.
C. 10,56g.
D. 11,00g.
Lời giải:
Chọn A
Gọi số mol của CH3COOH là 3a mol → số mol của CH3CH2OH là 2a mol
mX = 13,6 gam → 60.3a + 46.2a = 13,6 → a = 0,05 mol
Phương trình hóa học:
0,15 → 0,1 → mol
Giả sử hiệu suất là 100% thì rượu etylic hết, nên số mol sản phẩm phản ứng tính theo số mol rượu etylic.
neste lt = nrượu = 0,1 mol
Số mol este thực tế đã dùng là: neste thực tế = 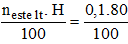
→ meste tt = n.M = 0,08.88 = 7,04 gam.
Câu 9: Cho 6,4g Cu tác dụng với oxi không khí thu được 6,4g CuO. Hiệu suất phản ứng là
A. 100%.
B. 80%.
C. 70%.
D. 60%.
Lời giải:
Chọn B
Chọn B
nCu = 6,4 : 64 = 0,1 mol ;
2Cu + O2 2CuO
1 → 1 mol
0,1 → 0,1 mol
Hiệu suất phản ứng là :
→ mCuO lt = 0,1.80 = 8 gam
H = 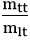
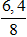
Câu 10: Cho phương trình: 2KMnO4 
Nhiệt phân 31,6 gam KMnO4, thu được V lít O2 (đktc), biết hiệu suất phản ứng 80% . Giá trị của V là
A. 2,24 lít
B. 1,792 lít
C. 10,08 lít
D. 8,96 lít
Lời giải:
Đáp án B
nKMnO4 = 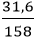
2KMnO4 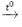
0,2 → 0,1 (mol)
Vì H% = 80% ⇒ nO2 thực tế = 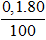
⇒ VO2 = 0,08.22,4 = 1,792 (lít)
Xem thêm các dạng bài tập Hóa học hay khác:
Lí thuyết về Peptit (2024) chi tiết nhất
Lí thuyết về Oxit lưỡng tính (2024) chi tiết nhất
Lí thuyết về Este (2024) chi tiết nhất