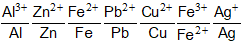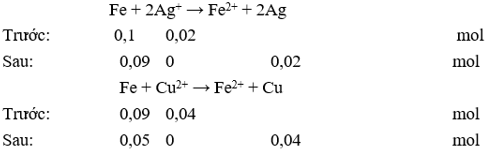Dãy điện hóa của kim loại
1. Lí thuyết
1.1 Khái niệm dãy điện hóa kim loại
Trong phản ứng hóa học, cation kim loại có thể nhận electron để trở thành nguyên tử kim loại và ngược lại, nguyên tử kim loại có thể nhường electron để tạo thành cation kim loại.
Cụ thể như:
Cu2+ + 2e 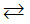
Ag+ + 1e 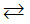
Tổng quát:
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử (Mn+/M).
Như vậy, dãy điện hóa của kim loại là dãy những cặp oxi hóa - khử của kim loại được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại.
1.2 Ý nghĩa của dãy điện hóa kim loại
So sánh tính oxi hóa – khử
- Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
- Cụ thể như:
+ Kim loại Na có tính khử mạnh do đó ion Na+ có tính oxi hóa yếu.
+ Ion Ag+ có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
Xác định chiều phản ứng oxi hóa – khử
Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
Xét một phản ứng oxi hóa - khử xảy ra hay không
Để xét một phản ứng oxi hóa – khử có xảy ra hay không cần nắm được quy tắc alpha:
Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
2. Bài tập vận dụng
Câu 1: Tính oxi hoá của các ion kim loại: Mg2+, Fe3+, Fe2+, Cu2+, Ag+ giảm dần theo thứ tự sau:
A. Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
B. Mg2+, Mg2+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+, Fe3+.
C. Fe3+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+, Mg2+, Mg2+.
D. Mg2+, Mg2+, Fe3+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+.
Hướng dẫn giải:
Chọn A
Các ion được sắp xếp theo đúng trật tự trong dãy điện hóa là:
Mg2+, Fe2+, Cu2+, Fe3+, Ag+.
Theo chiều từ trái sang phải trong dãy điện hóa tính oxi hóa của ion kim loại tăng dần.
→ Chiều giảm dần tính oxi hóa của ion kim loại là:
Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
Câu 2: Tính khử của các kim loại Fe, Al, Cu, Ag, Zn giảm dần theo thứ tự:
A. Al, Cu , Ag , Zn, Fe.
B. Fe, Cu , Ag , Al, Zn.
C. Fe , Al, Cu , Ag , Zn.
D. Al, Zn, Fe, Cu, Ag.
Hướng dẫn giải:
Chọn D
Các kim loại được sắp xếp theo đúng trật tự trong dãy điện hóa là:
Al, Zn, Fe, Cu, Ag.
Theo chiều từ trái sang phải trong dãy điện hóa tính khử của kim loại giảm dần.
→ Chiều giảm dần tính khử của kim loại là:
Al, Zn, Fe, Cu, Ag.
Câu 3: Cho các phản ứng hoá học dưới dạng ion thu gọn:
3Mg + 2Al3+ → 3Mg2+ + 2Al (1)
Al + 3Fe3+ → 3Fe2+ + Al3+ (2)
2Al + 3Fe2+ → 2Al3+ + 3Fe (3)
Tính oxi hoá của các ion kim loại được sắp xếp theo thứ tự giảm dần là
A. Al3+; Fe3+; Fe2+; Mg2+.
B. Fe3+; Fe2+; Al3+; Mg2+.
C. Mg2+; Fe2+; Fe3+; Al3+.
D. Al3+; Mg2+; Fe2+; Fe3+.
Hướng dẫn giải
Chọn B
Ta có: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
Từ phương trình (1) có: Tính oxi hóa Al3+ > Mg2+.
Từ phương trình (2) có: Tính oxi hóa Fe3+ > Al3+; Fe3+ > Fe2+.
Từ phương trình (3) có: Tính oxi hóa của Fe2+ > Al3+.
Vậy chiều giảm dần tính oxi hóa: Fe3+; Fe2+; Al3+; Mg2+.
Câu 4: Cho các kim loại Mg, Al, Zn, Cu. Tính oxi hoá của ion kim loại tăng dần là
A. Cu2+ < Zn2+ < Al3+ < Mg2+.
B. Cu2+ < Mg2+ < Al3+ < Zn2+.
C. Mg2+ < Al3+ < Zn2+ < Cu2+.
D. Cu2+ < Mg2+ < Zn2+ < Al3+.
Hướng dẫn giải:
Chọn C
Dựa vào dãy điện hóa có chiều giảm dần tính khử của kim loại là:
Mg, Al, Zn, Cu.
Ta có: kim loại có tính khử càng yếu thì ion kim loại có tính oxi hóa càng mạnh.
→ Chiều tăng dần tính oxi hóa của ion kim loại là:
Mg2+ < Al3+ < Zn2+ < Cu2+.
Câu 5: Trong các kim loại Fe, Cu, Ag, Mg kim loại khử được ion Cu2+ là:
A. Fe, Mg, Ag.
B. Fe , Ag.
C. Mg, Ag.
D. Mg, Fe.
Hướng dẫn giải:
Chọn D
Theo dãy điện hóa thì Mg và Fe đứng trước Cu, do đó Mg và Fe khử được ion Cu2+.
Câu 6: Trong dãy điện hoá, cặp oxi hoá - khử Fe3+ / Fe2+ đứng sau cặp Cu2+ / Cu0 thì tính oxi hoá:
A. Fe3+ > Cu2+.
B. Fe3+ < Cu2+.
C. Fe2+ > Fe3+.
D. Fe2+ > Cu2+.
Hướng dẫn giải:
Chọn A.
Câu 7: Từ phương trình ion thu gọn sau: Cu + 2Ag+ → Cu2+ + 2Ag.
Kết luận nào dưới đây không đúng?
A. Cu2+ có tính oxi hoá mạnh hơn Ag+.
B. Cu có tính khử mạnh hơn Ag.
C. Ag+ có tính oxi hoá mạnh hơn Cu2+.
D. Cu bị oxi hoá bởi ion Ag+.
Hướng dẫn giải:
Chọn A
Phản ứng xảy ra theo chiều: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
→ A sai vì Ag+ có tính oxi hoá mạnh hơn Cu2+.
Câu 8: Cho một ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm các chất tan là
A. Fe(NO3)2.
B. Fe(NO3)2, AgNO3 dư.
C. Fe(NO3)3, AgNO3 dư.
D. Fe(NO3)2, Fe(NO3)3, AgNO3.
Hướng dẫn giải:
Chọn C
Ta có các PTHH xảy ra như sau:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Sau đó tiếp tục có phản ứng:
AgNO3 dư + Fe(NO3)2 → Fe(NO3)3 + Ag
Vậy các chất tan có trong dung dịch sau phản ứng là: Fe(NO3)3, AgNO3 dư.
Câu 9: Ngâm đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 0,8 gam. Nồng độ CuSO4 ban đầu là
A. 0,52 M.
B. 0,5 M.
C. 5 M.
D. 0,25 M.
Hướng dẫn giải:
Chọn B.
Fe + CuSO4 → FeSO4 + Cu
a → a mol
mđinh sắt tăng = mCu sinh ra (bám vào) – mFe pư
hay 0,8 = 64a – 56a → a = 0,1 mol
CM(CuSO4) = 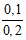
Câu 10: Ngâm Cu dư vào dung dịch AgNO3 thu được dung dịch X, sau đó ngâm Fe dư vào dung dịch X thu được dung dịch Y. Dung dịch Y gồm:
A. Fe(NO3)2.
B. Fe(NO3)2, Cu(NO3)2, AgNO3.
C. Fe(NO3)2, Cu(NO3)2.
D. Fe(NO3)3.
Hướng dẫn giải:
Chọn A
Cho Cu dư vào AgNO3:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
→ Dung dịch X là Cu(NO3)2.
Ngâm sắt dư vào dung dịch X:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu.
Câu 11: Phương trình phản ứng sai là
A. Zn + Pb2+ → Zn2+ + Pb.
B. Cu + 2Fe3+ → 2Fe2+ + Cu2+.
C. Cu + Fe2+ → Cu2+ + Fe.
D. Al + 3Ag+ → Al3+ + Ag.
Hướng dẫn giải:
Chọn C
Các cặp oxi hóa – khử được sắp xếp theo đúng trật tự trong dãy điện hóa:
Vậy phản ứng C sai do cặp Cu2+/ Cu đứng sau cặp Fe2+/ Fe do đó Cu không thể khử được Fe2+ thành Fe.
Câu 12: Cho 5,6g Fe vào 200 ml dung dịch hỗn hợp AgNO3 0,1M và Cu(NO3)2 0,2M. Sau khi kết thúc phản ứng thu được chất rắn có khối lượng là
A. 4,72g.
B. 5,28g.
C. 7,52g.
D. 2,56g.
Hướng dẫn giải:
Chọn C
Ta có: nFe = 0,1 mol; nAg+ = 0,02 mol; nCu2+ = 0,04 mol.
Phản ứng xảy ra theo thứ tự sau:
Chất rắn sau phản ứng gồm: Fe dư: 0,05 mol; Ag: 0,02 mol; Cu: 0,04 mol
Khối lượng chất rắn sau phản ứng: m = 0,05.56 + 0,02.108 + 0,04.64 = 7,52 gam.
Câu 13: Cho 0,01 mol Fe vào 50 ml dung dịch AgNO3 1M. Sau khi phản ứng kết thúc thì lượng Ag thu được là
A. 2,16g
B. 5,4g
C. 3,24g
D. giá trị khác.
Hướng dẫn giải:
Số mol AgNO3: 0,05 mol
Phản ứng xảy ra theo thứ tự sau:
→ nAg = 0,03 mol, mAg = 0,03.108 = 3,24 gam.
Câu 14: Cho thanh Fe vào 100ml dung dịch Cu(NO3)2 0,1M. Khi phản ứng kết thúc thì khối lượng thanh Fe
A. giảm 0,56 g.
B. giảm 0,08 g.
C. tăng 0,08 g.
D. tăng 0,80 g.
Hướng dẫn giải:
Chọn C
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
0,01 ← 0,01 → 0,01 mol
Ta có: mCu sinh ra – mFe pư = (64 – 56).0,01 = 0,08 gam.
Vậy khối lượng thanh sắt tăng 0,08 gam.
Câu 15: Cho một mẩu kim loại kali vào lượng dư dung dịch CuSO4 thì thu được sản phẩm cuối cùng gồm:
A. Cu(OH)2, K2SO4 và H2.
B. Cu(OH)2 và K2SO4.
C. Cu và K2SO4.
D. KOH và H2.
Hướng dẫn giải:
Chọn A
Phản ứng xảy ra như sau:
2K + 2H2O → 2KOH + H2 ↑
2KOH + CuSO4 → K2SO4 + Cu(OH)2 ↓
Vậy sản phẩm cuối cùng gồm: H2; K2SO4, Cu(OH)2.
Xem thêm các dạng bài tập Hóa học hay khác:
Dãy hoạt động hóa học của kim loại (2024) chi tiết nhất
Tính chất hóa học của oxit, khái quát về sự phân loại oxit (2024) chi tiết, hay nhất.
Tính chất hóa học của oxit axit (2024) chi tiết nhất
Cách viết công thức cấu tạo của hợp chất hữu cơ (2024) hay nhất