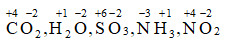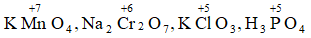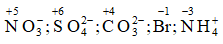Bài tập Xác định số oxi hóa của Nitơ (N) trong hợp chất
I. Lí thuyết
1. Vị trí và cấu hình
- Nitơ (nitrogen) ở ô thứ 7, nhóm VA, chu kì 2 của bảng tuần hoàn.
- Cấu hình electron nguyên tử của nitơ là 1s22s22p3.
⇒ Ba electron ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác.
- Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba: N ≡ N .
2. Tính chất vật lí
- Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -196 oC.
- Khí nitơ tan rất ít trong nước.
- Nitơ không duy trì sự cháy và sự hô hấp.
3. Tính chất hóa học
- Liên kết ba trong phân tử nitơ rất bền.
⇒ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
- Ở nhiệt độ cao, nitơ có thể tác dụng được với nhiều chất.
- Khi tham gia phản ứng oxi hóa - khử, số oxi hóa của nitơ có thể giảm hoặc tăng, do đó nó thể hiện tính oxi hóa hoặc tính khử.
- Tính oxi hóa vẫn là tính chất chủ yếu của nitơ.
a. Tính oxi hóa
Trong phản ứng với kim loại và hiđro, số oxi hóa của nguyên tố nitơ giảm từ 0 đến -3, nitơ thể hiện tính oxi hóa
Tác dụng với kim loại
- Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al,... tạo thành nitrua kim loại.
Thí dụ:
3Mg+0N2→t°
Chú ý: Li có thể phản ứng với N2 ở ngay nhiệt độ thường.
Tác dụng với hiđro
- Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ tác dụng trực tiếp với hiđro, tạo ra khí amoniac.
b. Tính khử
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi, tạo ra khí nitơ monooxit NO.
- Trong thiên nhiên, khí NO được tạo thành khi có sấm sét.

Hình 1: Sấm sét cung cấp năng lượng cho phản ứng giữa N2 và O2 tạo thành NO
- Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi của không khí, tạo ra khí nitơ đioxit NO2 màu nâu đỏ.
Lưu ý: Các oxit khác của nitơ như N2O, N2O3, N2O5, chúng không điều chế được bằng tác dụng trực tiếp giữa nitơ và oxi.
II. Phương pháp xác định số oxi hóa
- Quy tắc 1 : Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
Ví dụ : Số oxi hóa của các nguyên tố Na, Fe, H, O, Cl trong đơn chất tương ứng Na, Fe, H2, O2, Cl2 đều bằng 0.
- Quy tắc 2 : Trong hầu hết các hợp chất :
Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
- Quy tắc 3 : Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
- Quy tắc 4 : Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
Ví dụ : Số oxi hóa của Na, Zn, S và Cl trong các ion Na+, Zn2+, S2-, Cl- lần lượt là : +1, +2, –2, –1.
Tổng đại số số oxi hóa của các nguyên tố trong các ion SO42-, MnO4-, NH4+ lần lượt là : –2, –1, +1.
Chú ý: Để biểu diễn số oxi hóa thì viết dấu trước, số sau, còn để biểu diễn điện tích của ion thì viết số trước, dấu sau.
Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -) thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ (+1 hoặc –1).
Trong hợp chất, kim loại kiềm, kiềm thổ, nhôm luôn có số oxi hóa lần lượt là : +1, +2, +3.
III. Ví dụ minh họa
Ví dụ 1: Chiều tăng dần số oxi hoá của N trong các hợp chất của nitơ dưới đây là
Chọn một đáp án dưới đây
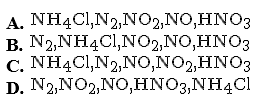
Đáp án là : (C)
Ví dụ 2: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Lời giải:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2- , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Ví dụ 3: Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Trong các axit, axit nitric là axit mạnh nhất
B. Khả năng oxi hoá giảm dần do độ âm điện giảm dần
C. Tính phi kim tăng dần, đồng thời tính kim loại giảm dần
D. Tính axit của các oxit giảm dần, đồng thời tính bazơ tăng dần
Đáp án là : (C)
Ví dụ 4: Trong nhóm N, khi đi từ N đến Bi, điều khẳng định nào dưới đây không đúng?
Chọn một đáp án dưới đây
A. Độ âm điện các nguyên tố giảm dần
B. Bán kính của nguyên tử các nguyên tố tăng dần
C. Năng lượng ion hoá của các nguyên tố giảm dần
D. Nguyên tử các nguyên tố đều có cùng số lớp electron
Đáp án là : (D)
Ví dụ 5: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm nitơ (VA) là cấu hình nào dưới đây?
Chọn một đáp án dưới đây
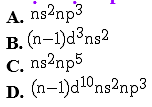
Đáp án là : (A)
IV. Bài tập vận dụng
Bài 1: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3 B. 3 và +5
C. 5 và +5 D. 3 và -3
Lời giải:
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Bài 2: Số oxi hoá của nguyên tố nitơ trong các hợp chất : NH4Cl, HNO3, NO, NO2, N2,N2O lần lượt là :
A. - 4, +6, +2, +4, 0, +1
B. 0, +1,–4, +5, –2, 0
C. -3, +5, +2,+4, 0,+1
D. 0, +1.+3, –5, +2, –4
Đáp án C.
Gọi số oxi hóa của N là x, số oxi hóa trong hợp chất của H =+1, O = -2.
Bài 3: Số oxi hóa của nitơ trong NH4+ , NO2-, và HNO3 lần lượt là:
A. +5, -3, +3
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3
Đáp án B
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+ , NO2-, và HNO3
Ta có:
x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+ là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
Bài 4: Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Lời giải:
Áp dụng quy tắc xác định số oxi hóa:
+) Phân tử:
+) Ion: Số oxi hóa của Na+ , Cu2+, Fe2+ , Fe3+, Al3+ lần lượt là: +1, +2, +2, +3, +3
Bài 5: Hãy xác định số oxi hóa của các nguyên tố:
- Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
- Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
- Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
- Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
- Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
Lời giải:
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2.(-2) = 0 → x = +4.
Trong N2O5: 2x + 5.(-2) = 0 → x = +5.
Trong HNO3: (+1) + x + 3.(-2) = 0 → x = +5.
Trong HNO2: (+1) + x +2.(-2) = 0 → x = +3.
Trong NH3 : x + 3.(+1) = 0 → x = -3.
Trong NH4Cl: x + 4.(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:
Số oxi hóa của Cl trong:
Số oxi hóa của Mn trong :
Số oxi hóa của Cr trong :
Số oxi hóa của S trong :
Bài 6: Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4 , Na2Cr2O7, KClO3, H3PO4
Lời giải:
Số oxi hóa của Mn, Cr, P:
Bài 7: Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42- ; CO32- , Br, NH4+
Lời giải:
Số oxi hóa của N, S, C, Br:
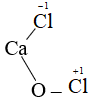
Bài 8: Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Lời giải:
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
Bài 9: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Lời giải:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Xem thêm các dạng bài tập Hóa học hay khác:
30 Bài tập Xác định số oxi hóa của Sắt (Fe) trong hợp chất (2024) có đáp án
30 Bài tập xác định số oxi hóa của Clo (Cl) trong hợp chất (2024) có đáp án
30 Bài tập tính theo công thức hóa học (2024) có đáp án