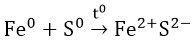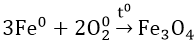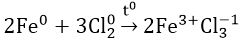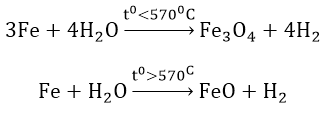Bài tập xác định số oxi hóa của Sắt (Fe) trong hợp chất
I. Lí thuyết
1. Vị trí, cấu tạo
- Fe thuộc ô 26, chu kì 4, nhóm VIIIB
- Cấu hình e: 1s22s22p63s23p63d64s2 ⇒ Fe là nguyên tố d, có 2e ngoài cùng, 8e hoá trị II.
2. Tính chất vật lí
- Fe là kim loại nặng, dễ rèn, màu trắng hơi xám.
- Có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ (khác với các kim loại khác).
- Fe có cấu tạo mạng tinh thể lập phương tâm diện hoặc tâm khối tuỳ vào nhiệt độ.
3. Tính chất hóa học
a. Tác dụng với phi kim:
- Tác dụng với lưu huỳnh:
- Tác dụng với oxi:
- Tác dụng với Cl2:
b. Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2↑
- Với dung dịch HNO3 và H2SO4 đặc, nóng:
Fe + 4HNO4 loãng → Fe(NO3)3 + NO + 2H2O
- Chú ý: Fe bị thụ động với các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
c. Tác dụng với dung dịch muối
Fe + CuSO4 → FeSO4 + Cu↓
d. Tác dụng với nước ở nhiệt độ cao
II. Ví dụ minh họa
Ví dụ 1: Tính chất vật lí nào sau đây không phải của sắt?
A. Kim loại nặng, khó nóng chảy.
B. Màu vàng nâu, dẻo, dễ rèn.
C. Dẫn điện và dẫn nhiệt tốt.
D. Có tính nhiễm từ.
Đáp án: B
Giải thích:
Tính chất vật lý của sắt:
- Có màu trắng hơi xám.
- Dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC
- Là kim loại nặng, có khối lượng riêng d = 7,9 g/cm3
- Dẫn điện, dẫn nhiệt tốt.
- Là kim loại có từ tính, bị nam châm hút.
→ Khẳng định sắt có màu vàng nâu là sai.
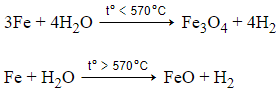
Ví dụ 2: Sắt tác dụng với H2O ở nhiệt độ cao hơn 570°C thì tạo ra H2 và sản phẩm rắn là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe(OH)2.
Đáp án: A
Giải thích:
Ví dụ 3: Hợp chất nào sau đây của sắt vừa có tính khử, vừa có tính oxi hóa?
A. FeO.
B. Fe2O3.
C. Fe(OH)3.
D. Fe2(SO4)3.
Đáp án: A
Giải thích:
Trong hợp chất FeO số oxi hóa của Fe là +2 → Fe có thể tăng số oxi hóa lên +3 hoặc giảm số oxi hóa về 0. Nên FeO vừa có tính khử, vừa có tính oxi hóa.
III. Bài tập vận dụng
Câu 1: Phản ứng xảy ra khi đốt cháy sắt trong không khí là
A. 3Fe + 2O2 →t° Fe3O4.
B. 4Fe + 3O2 2Fe2O3.
C. 2Fe + O2 2FeO.
D. Fe + O2 FeO2.
Đáp án: A
Giải thích:
Đốt cháy sắt trong không khí tạo thành Fe3O4
Câu 2: Kim loại Fe thụ động bởi dung dịch
A. H2SO4 loãng
B. HCl đặc, nguội
C. HNO3 đặc, nguội
D. HCl loãng
Đáp án: C
Giải thích:
Fe thụ động trong dung dịch HNO3 đặc, nguội và H2SO4 đặc, nguội.
Câu 3: Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe(II)?
A. Cl2
B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư
D. dung dịch HCl đặc
Đáp án: D
Giải thích:
A. 2Fe + 3Cl2 → 2FeCl3
B. Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
C. Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 dư→ Fe(NO3)3 + Ag
D. Fe + 2HCl → FeCl2 + H2
Câu 4: Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn A. Cho A tác dụng với dung dịch HCl dư, thu được khí B. Tỉ khối của B so với không khí là
A. 0,8045
B. 0,7560
C. 0,7320
D. 0,9800
Đáp án: A
Giải thích:
Fe + S FeS
nFeS = nS = nFe phản ứng = 0,2 mol
→ nFe dư = 0,3 – 0,2 = 0,1 mol
→ Chất rắn A gồm Fe dư: 0,1 mol và FeS: 0,2 mol
→ A phản ứng với HCl thu được khí gồm H2: 0,1 mol và H2S: 0,2 mol
Mkhí =
→ Tỉ khối của A với không khí là 0,8045.
Câu 5: Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 2M là
A. 25 ml.
B. 50 ml.
C. 100 ml.
D. 150 ml.
Đáp án: B
Giải thích:
Áp dụng định luật bảo toàn khối lượng
mFe + mO = m oxit
→ 2,24 + mO = 3,04
→ mO = 0,8 gam
→ nO = 0,05 mol
Áp dụng bảo toàn nguyên tố
Oxit + HCl muối clorua + H2O
nHCl = nH (axit) = 2.nO
= 2.0,05 = 0,1 mol
→ Vdd HCl 2M = = 0,05 lít = 50 ml
Câu 6: Để 4,2 gam sắt trong không khí một thời gian thu được 5,32 gam hỗn hợp X gồm sắt và các oxit của nó. Hòa tan hết X bằng dung dịch HNO3, thấy sinh ra 0,448 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Vậy khối lượng muối khan thu được khi cô cạn dung dịch Y là
A. 13,5 gam.
B. 15,98 gam.
C. 16,6 gam.
D. 18,15 gam.
Đáp án: C
Giải thích:
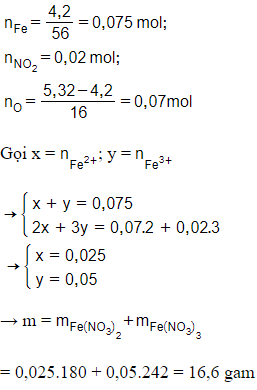
Câu 7: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là
A. 10,8 và 4,48.
B. 10,8 và 2,24.
C. 17,8 và 4,48.
D. 17,8 và 2,24.
Đáp án: D
Giải thích:
= 0,8.0,2 = 0,16 mol
= 0,8.0,25 = 0,2 mol
Do sau phản ứng còn dư hỗn hợp bột kim loại
→ Fe còn dư, Cu2+ hết, thu muối Fe2+
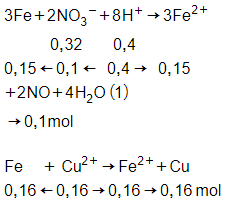
VNO = 0,1.22,4 = 2,24 lít
m – (0,15 + 0,16).56 + 0,16.64 = 0,6m
→ m = 17,8 gam
Câu 8: Trong 3 chất Fe, Fe2+, Fe3+. Chất X chỉ có tính khử, chất Y chỉ có tính oxi hoá, chất Z vừa có tính khử vừa có tính oxi hóa. Các chất X, Y, Z lần lượt là:
A. Fe, Fe2+ và Fe3+.
B. Fe2+, Fe và Fe3+.
C. Fe3+, Fe và Fe2+.
D. Fe, Fe3+ và Fe2+.
Đáp án: D
Giải thích:
+) Fe đơn chất có số oxi hóa bằng 0 → có khả nhường 2e hoặc 3e → chỉ có tính khử → X là Fe
+) Fe2+ có khả năng nhường 1e để thành Fe3+ → có tính khử
Fe2+ có khả năng nhận 2e để thành Fe đơn chất → có tính oxi hóa
→ Z là Fe2+
+) Fe3+ chỉ có khả năng nhận 1e để trở nhà Fe2+ hoặc nhận 3e để thành Fe đơn chất → Fe3+ chỉ có tính oxi hóa → Y là Fe3+
Câu 9: Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây?
A. Fe + dung dịch AgNO3 dư
B. Fe + dung dịch Cu(NO3)2
C. FeO + dung dịch HNO3
D. FeS + dung dịch HNO3
Đáp án: B
Giải thích:
B. Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Câu 10: Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối Y. Phần hai cho tác dụng với dung dịch HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thề là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Đáp án: D
Giải thích:
Kim loại X là Fe
Phần 1: 2Fe (X) + 3Cl2 2FeCl3 (Y)
Phần 2: Fe (X) + 2HCl → FeCl2 (Z) + H2
Fe (X) + 2FeCl3 (Y) → 3FeCl2 (Z)
Xem thêm các dạng bài tập Hóa học hay khác:
30 Bài tập xác định số oxi hóa của Clo (Cl) trong hợp chất (2024) có đáp án
20 Bài tập thủy phân chất béo trong môi trường kiềm (2024) có đáp án
30 Bài tập tính theo công thức hóa học (2024) có đáp án