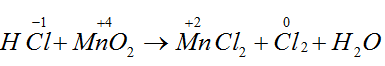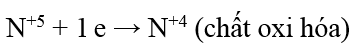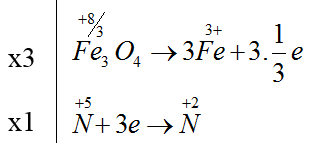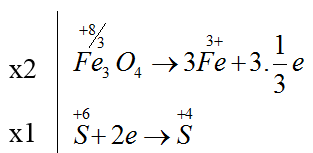Phản ứng oxi hóa - khử
1. Lý thuyết và phương pháp giải
1.1 Chất oxi hóa, chất khử
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Ví dụ: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O2, mẩu than cháy sáng.
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử O2 nhận 4 electron, là chất oxi hóa.
(quá trình oxi hóa)
(quá trình khử)
1.2 Phản ứng oxi hóa – khử
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Ví dụ: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
(a) CaCO3 CaO + CO2.
(b) BaCl2 + Na2SO4 BaSO4¯ + 2NaCl.
(c) 4Al + 3O2 2Al2O3.
Hướng dẫn giải:
(a) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(b) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(c) : có sự thay đổi số oxi hóa của nguyên tố Al, O Đây là phản ứng oxi hóa – khử.
1.3 Phương pháp giải
Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
Ví dụ: Cân bằng phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron: NH3 + O2NO + H2O.
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
NH3: chất khử; O2: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
4NH3 + 5O2 4NO + 6H2O
2. Ví dụ minh họa
Ví dụ 1. Số oxi hóa của Fe trong ion Fe3+ là
A. +2.
B. –2.
C. +3.
D. 0.
Đáp án: C
Giải thích:
Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion.
Số oxi hóa của Fe trong ion Fe3+ là +3.
Ví dụ 2. Số oxi hóa của C trong ion![]() là
là
A. –2.
B. +2.
C. +4.
D. +6.
Đáp án: C
Giải thích:
Số oxi hóa của O là – 2.
Gọi số oxi hóa của C trong ion đa nguyên tử ![]() là x.
là x.
Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ta có: x + (3–2)×3 = –2 x = +4.
Ví dụ 3. Chất khử là
A. chất nhận electron.
B. chất nhường electron.
C. chất vừa nhường electron, vừa nhận electron.
D. không nhường hay nhận electron.
Đáp án: C
Giải thích:
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Ví dụ 4. Phát biểu nào sau đây là đúng?
A. Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
B. Quá trình oxi hóa là quá trình chất khử nhận electron, quá trình khử là quá trình chất oxi hóa nhường electron.
C. Quá trình oxi hóa và quá trình khử đều là quá trình nhường electron.
D. Quá trình oxi hóa và quá trình khử đều là quá trình nhận electron.
Đáp án: A
Giải thích:
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
3. Bài tập vận dụng
Câu 1. Phản ứng oxi hóa – khử là
A. phản ứng hóa học chỉ xảy ra quá trình nhường electron.
B. phản ứng hóa học chỉ xảy ra quá trình nhận electron.
C. phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
D. phản ứng oxi hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Đáp án: C
Giải thích:
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Câu 2. Điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn được gọi là
A. hóa trị.
B. điện tích.
C. số oxi hóa.
D. độ âm điện.
Đáp án: C
Giải thích:
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Câu 3. Số oxi hóa được viết ở dạng
A. số đại số, dấu viết trước, số viết sau.
B. số đại số, dấu viết sau, số viết trước.
C. số đại số, nếu là số oxi hóa âm thì cần viết thêm dấu ở trước.
D. số đại số, nếu là số oxi hóa âm thì cần viết thêm dấu ở sau.
Đáp án: B
Giải thích:
Số oxi hóa được viết ở dạng số đại số, dấu viết trước, số viết sau.
Ví dụ: Trong hợp chất, nguyên tử nguyên tố Na có số oxi hóa là +1.
Câu 4. Trong đơn chất, số oxi hóa của nguyên tử bằng
A. 0.
B. +1.
C. –1.
D. –2.
Đáp án: A
Giải thích:
Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: ![]() .
.
Câu 5. Số oxi hóa của S trong phân tử K2SO4 là
A. –2.
B. 0.
C. +4.
D. +6.
Đáp án: D
Giải thích:
Trong hợp chất, số oxi hóa của K là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: ![]() .
.
Ta có: (+1)×2 + x + (–2)×4 = 0 x = +6.
Câu 6. Số oxi hóa của N trong phân tử HNO3 là
A. –3.
B. +1.
C. +2.
D. +5.
Đáp án: D
Giải thích:
Trong hợp chất, số oxi hóa của H là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: ![]() .
.
Ta có: (+1) + x + (–2)×3 = 0 x = +5.
Câu 7. Cho phương trình hóa học của phản ứng: C + O2 ![]() CO2. Xác định chất khử, chất oxi hóa.
CO2. Xác định chất khử, chất oxi hóa.
A. C là chất khử; CO2 là chất oxi hóa.
B. O2 là chất khử; C là chất oxi hóa.
C. CO2 là chất khử; C là chất oxi hóa.
D. C là chất khử; O2 là chất oxi hóa.
Đáp án: D
Giải thích:
Phương trình hóa học: ![]()
Chất khử là chất nhường electron (số oxi hóa tăng sau phản ứng); chất oxi hóa là chất nhận electron (số oxi hóa giảm sau phản ứng).
C là chất khử; O2 là chất oxi hóa.
Câu 8. Cho phương trình hóa học: Cl2 + H2O HCl + HClO. Trong phản ứng trên, Cl2 là
A. chất oxi hóa.
B. chất khử.
C. vừa là chất oxi hóa, vừa là chất khử.
D. không là chất oxi hóa, không là chất khử.
Đáp án: C
Giải thích:
Phương trình hóa học: ![]() .
.
Số oxi hóa của Cl vừa tăng từ 0 lên +1, vừa giảm từ 0 xuống –1.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
Câu 9. Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. NaOH + HCl NaCl + KOH.
B. CO2 + NaOH NaHCO3.
C. BaCl2 + K2SO4 BaSO4 + 2KCl.
D. 2Na + 2H2O 2NaOH + H2.
Đáp án: D
Giải thích:
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
![]() : không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
: không có nguyên tử nguyên tố nào thay đổi số oxi hóa không phải là phản ứng oxi hóa – khử.
![]() : có sự thay đổi số oxi hóa của nguyên tử Na (từ 0 lên +1) và nguyên tử H (từ +1 xuống 0) Đây là phản ứng oxi hóa – khử.
: có sự thay đổi số oxi hóa của nguyên tử Na (từ 0 lên +1) và nguyên tử H (từ +1 xuống 0) Đây là phản ứng oxi hóa – khử.
Câu 10. Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc:
A. Số chất khử bằng số chất oxi hóa.
B. Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
C. Số nguyên tử có số oxi hóa tăng bằng số nguyên tử có số oxi hóa giảm.
D. Tổng số hóa trị của các nguyên tố trong chất khử bằng tổng số hóa trị của các nguyên tố chất oxi hóa.
Đáp án: B
Giải thích:
Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
Câu 11. Cho phương trình hóa học của phản ứng:
aCu + bHNO3 cCu(NO3)2 + dNO + eH2O (a, b, c, d, e là các số nguyên)
Tổng hệ số của các chất tham gia phản ứng là
A. 9.
B. 11.
C. 16.
D. 20.
Đáp án: B
Giải thích:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
a![]() + b
+ b![]() c
c![]() + d
+ d![]() + eH2O.
+ eH2O.
Cu: chất khử; HNO3: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
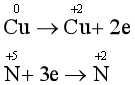
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
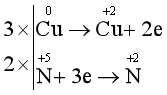
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O
Tổng hệ số của các chất tham gia phản ứng là: a + b = 3 + 8 = 11.
Bài 12: Trong phản ứng dưới đây, vai trò của HCl là: MnO2 + 4HCl → MnCl2 +Cl2+ 2H2O
A. oxi hóa. B. chất khử. C. tạo môi trường. D. chất khử và môi trường.
Lời giải:
Đáp án D.
Bài 13: Cho phản ứng: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. Trong phản ứng trên, HNO3 đóng vai trò là :
A. chất oxi hóa. B. axit. C. môi trường. D. chất oxi hóa và môi trường.
Lời giải:
Đáp án D.
Bài 14: Hòa tan Cu2S trong dung dịch HNO3 loãng, nóng, dư, sản phẩm thu được là :
A. Cu(NO3)2 + CuSO4 + H2O. B. Cu(NO3)2 + H2SO4 + NO + H2O.
C. Cu(NO3)2 + H2SO4 + H2O. D. Cu(NO3)2 + CuSO4 + NO2 + H2O.
Lời giải:
Đáp án B.
HNO3 loãng cho sản phẩm khử là NO.
Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O.
Bài 15: Phản ứng nhiệt phân muối thuộc phản ứng :
A. oxi hóa – khử. B. không oxi hóa – khử.
C. oxi hóa – khử hoặc không. D. thuận nghịch.
Lời giải:
Đáp án C.
Ví dụ: CaCO3 → CaO + CO2 (Không phải phản ứng oxi hóa – khử)
KNO3 → KNO2 + O2 (Phản ứng oxi hóa – khử).
Bài 16: Cho các phản ứng
Ca(OH)2 + Cl2 → CaOCl2 + H2O
2H2S + SO2 → 3S + 2H2O
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4KClO3 → KCl + 3KClO4.
Số phản ứng oxi hóa – khử là:
A. 1 B. 2 C. 3 D. 4.
Lời giải:
Đáp án D
Cả 4 phản ứng đều có sự thay đổi số oxi hóa.
Bài 17: Loại phản ứng hoá học nào sau đây luôn luôn là phản ứng oxi hóa-khử ?
A. Phản ứng hoá hợp B. Phản ứng phân huỷ
C . Phản ứng thế D. Phản ứng trung hoà
Lời giải:
Đáp án C.
Ví dụ cho các trường hợp ngoại lệ không phải phản ứng oxi hóa khử
A. CaO + CO2 → CaCO3
B. CaCO3 → CaO + CO2
D. HCl + NaOH → NaCl + H2O.
Bài 18: Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là :
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
A. 55. B. 20. C. 25. D. 50.
Lời giải:
Đáp án A
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Tổng hệ số cân bằng của các chất= 3 + 28 + 9 + 1 + 14 = 55
Bài 19: Hãy cho biết những cặp khái niệm nào tương đương nhau ?
A. quá trình oxi hóa và sự oxi hóa. B. quá trình oxi hóa và chất oxi hóa.
C. quá trình khử và sự oxi hóa. D. quá trình oxi hóa và chất khử.
Lời giải:
Đáp án A.
Bài 20: Khi tham gia vào các phản ứng hoá học, nguyên tử kim loại
A. bị khử. B. bị oxi hoá. C. cho proton. D. nhận proton.
Lời giải:
Đáp án B.
Nguyên tử kim loại sẽ nhường electron,là chất khử và bị oxi hóa.
Bài 21: Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là:
Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
A. 21. B. 26. C. 19. D. 28.
Lời giải:
Đáp án B
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O
Tổng hệ số cân bằng = 2 + 10 + 3 + 1+ 10 = 26
Bài 22: Cho sơ đồ phản ứng:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là :
A. 5 và 2. B. 2 và 10. C. 2 và 5. D. 5 và 1.
Lời giải:
Đáp án B
Chất oxi hóa và chất khử lần lượt là KMnO4 và FeSO4.
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Bài 23: Loại phản ứng hoá học nào sau đây luôn luôn không phải là phản ứng oxi hoá-khử ?
A . Phản ứng hoá hợp B. Phản ứng phân huỷ
C. Phản ứng thế D. Phản ứng trao đổi
Lời giải:
Đáp án D.
Bài 24: Phản ứng nào sau đây vừa là phản ứng hóa hợp, vừa là phản ứng oxi hóa – khử?
A. CaO + H2O → Ca(OH)2 B. 2NO2 → N2O4
C. 2NO2 + 4Zn → N2 + 4ZnO D. 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Lời giải:
Đáp án D.
Phản ứng hóa hợp là từ hai hay nhiều chất ban đầu tạo thành một chất.
Bài 25: Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử?
A. NH4NO2 → N2 + 2H2O B. CaCO3 → CaO + CO2
C. 8NH3 + 3Cl2 → N2 + 6NH4Cl D. 2NH3 + 3CuO → N2 + 3Cu + 3H2O
Lời giải:
Đáp án A.
Phản ứng phân hủy là từ một chất tạo thành 2 hay nhiều chất mới.
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 bài tập về Cấu tạo của bảng tuần hoàn các nguyên tố hóa học (2024) có đáp án chi tiết nhất
30 bài tập về phương pháp bảo toàn electron (2024) có đáp án chi tiết nhất
30 bài tập về biến thiên Enthalpy trong các phản ứng hóa học (2024) có đáp án chi tiết nhất
30 bài tập về lý thuyết liên kết hydrogen và tương tác van der Waals (2024) có đáp án chi tiết nhất