Bài tập Đồng và hợp chất của đồng
Kiến thức cần nhớ
ĐỒNG
I. VỊ TRÍ VÀ CẤU TẠO
- Đồng thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29.
- Cấu hình electron nguyên tử của Cu : [Ar] 3d104s1 ; Cu+ : [Ar] 3d10 ; Cu2+ :[Ar] 3d9 .
II. TÍNH CHẤT VẬT LÍ
Là kim loại màu nâu đỏ, khối lượng riêng lớn, dẻo, dễ kéo sợi và dát mỏng, dẫn điện, dẫn nhiệt tốt (chỉ kém hơn bạc).
III. TÍNH CHẤT HÓA HỌC
Tác dụng với phi kim
- Khi đốt nóng:
2Cu + O2 2CuO
Cu tác dụng với Cl2, Br2, S, ... ở nhiệt độ thường hoặc đun nóng:
Cu + Cl2 → CuCl2 (đồng clorua)
MỘT SỐ HỢP CHẤT CỦA ĐỒNG
I. ĐỒNG (II) OXIT
- CuO: là chất rắn màu đen, không tan trong nước
- Là oxit bazơ; dễ bị CO, C, H2 khử thành Cu kim loại
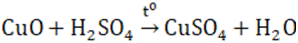
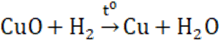
- Điều chế bằng cách nhiệt phân Cu(OH)2, Cu(NO3)2, CuCO3,…
II. ĐỒNG (II) HIDROXIT
- Cu(OH)2 : là chất rắn màu xanh
- Có tính bazơ, không tan trong nước nhưng tan dễ trong dung dịch axit
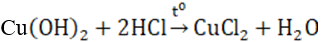
- Dễ bị nhiệt phân sinh ra CuO
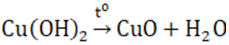
- Điều chế từ dung dịch muối đồng (II) và dung dịch bazơ.
III. MUỐI ĐỒNG (II)
- CuSO4dạng khan là chất rắn màu trắng, trạng muối hiđrat CuSO4.5H2O có màu xanh.
- Ứng dụng:
+ Trên 50% sản lượng dùng làm dây dẫn điện và trên 30% dùng làm hợp kim; hợp kim của đồng như đồng thau (Cu – Zn) ; đồng bạch (Cu–Ni) ; đồng thanh (Cu – Sn) ;… có rất nhiều ứng dụng trong công nghiệp và đời sống như: chế tạo chi tiết máy, thiết bị dùng trong công nghiệp đóng tàu biển
+ CuSO4 dùng trong nông nghiệp để chữa mốc sương cho cà chua, khoai tây; ở dạng khan thì dùng để phát hiện vết nước trong các chất lỏng
Các dạng bài tập Đồng và hợp chất của đồng
Dạng 1: Lí thuyết trọng tâm
Dạng 2: Đồng và hợp chất của đồng tác dụng với axit có tính oxi hóa
Phương pháp giải
*Kim loại Cu có tính khử yếu. Nên:
Cu + H+ + NO3- ( HNO3 ) → Cu+2 + sp khử: NO, NO2 + H2O
Cu + H2SO4(đặc nóng) → CuSO4 + sp khử: SO2 + H2O
Ví dụ 1: Cho 2,56 gam kim loại Cu phản ứng hoàn toàn với 25,2 gam dung dịch HNO3 60% thu được dung dịch A. Biết rằng nếu thêm 210ml dung dịch KOH 1M vào A rồi cô cạn và nung sản phẩm thu được tới khối lượng không đổi thì được 20,76 gam chất rắn. Hãy xác định nồng độ % của các chất trong A.
Lời giải
+ nCu= 0,04 mol; nHNO3(đầu)=0,24mol ; nKOH(đầu)=0,21mol
+ Cu nhường electron, N nhận electron.
+ Vì Cu có tính khử yếu nên sản phẩm khử: NO, NO2.
Sơ đồ: Cu → Cu(NO3)2 → Cu(OH)2 CuO
0,04 0,04 mol
KOH + HNO3 → KNO3 + H2O (1)
x x x mol
2KOH + Cu(NO3)2 →Cu(OH)2 + 2KNO3 (2)
0,08 0,04 0,04 0,08 mol
KNO3 → KNO2 + O2 (3)
0,08 + x 0.08+x mol
+ Rắn sau nung CuO: 0,04 mol; KNO2: 0,08+x; KOH( có thể dư ):0,13-x (mol)
80.0,04 + 85(0,08 +x) + 56(0,13-x)=20,76 → x = 0,12<0,13.
Vậy KOH dư
Dạng 3: Đồng tác dụng với phi kim
Phương pháp giải
Định luật bảo toàn khối lượng “Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các chất sản phẩm”
Điều này giúp ta giải bài toán hóa học một cách đơn giản, nhanh chóng
Xét phản ứng: A + B → C + D
Ta luôn có: mA + mB = mC + mD
Ngoài ra còn kết hợp phương pháp bảo toàn nguyên tố
Ví dụ 1: Đốt cháy hoàn toàn m gam Cu trong khí Cl2 dư, thu được 13,5 gam muối. Giá trị của m là bao nhiêu?
Hướng dẫn giải
Cu + Cl2 CuCl2
nCuCl2 = 0,1 mol
Bảo toàn nguyên tố → nCu = nCuCl2 = 0,1 mol
→ mCu = 0,1. 64 = 6,4 gam
Bài tập tự luyện
Câu 1: Cho A gam hỗn hợp sắt và đồng tác dụng với clo (đun nóng) thu được 18,9375 gam hỗn hợp sản phẩm. Hòa tan sản phẩm vào nước rồi cho tác dụng với dung dịch NaOH dư thu được 12,925 gam kết tủa. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Hướng dẫn giải
2Fe + 3Cl 2FeCl3
a a
Cu + Cl2 CuCl2
b b
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
a a
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
b b
mmuối = 162,5a + 135b = 18,9375 gam
mtủa = 107a + 98b = 12,925 gam
→ a = 0,75 mol; b= 0,05 mol
Khối lượng mỗi kim loại trong hỗn hợp là:
mFe = 56.0,75 = 4,2 gam
mCu = 64.0,05 = 3,2 gam
Câu 2: Giải thích hiện tượng xảy ra khi cho từ từ dung dịch NH3 vào dung dịch CuSO4 đến dư ?
Hướng dẫn giải
Cho từ từ dung dịch NH3 đến dư vào dd CuSO4 xảy ra các quá trình phản ứng sau:
+ Quá trình 1: 2NH3 + Cu2+ + 2H2O → Cu(OH)2↓ + 2NH4+.
+ Quá trình 2: 4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2.
Hiện tượng quan sát được: Ban đầu xuất hiện kết tủa màu xanh Cu(OH)2 sau đó kết tủa tan ra.
Giải thích quá trình 2: Sở dĩ NH3 còn đôi e chưa tham gia liên kết, ion Cu2+ còn obitan trống nên hai phân tử này kết hợp với nhau bằng các liên kết cho nhân tạo hợp chất phức.
Câu 3: Cho dòng khí CO dư đi qua 7,2 g CuO nung nóng ở nhiệt độ thích hợp cho đến khi phản ứng hoàn toàn thu được CO2 và Cu. Tính khối lượng Cu thu được sau phản ứng?
Hướng dẫn giải
CuO + CO Cu + CO2
Số mol CuO phản ứng là: nCuO =0,09mol
Ta có: nCO = nCO2 = nCu = nCuO = 0,09mol
Khối lượng Cu thu được sau phản ứng là: mCu = 0,09. 64 = 5,76g
Câu 4: Cho 4,48 lít NH3 (đktc) đi qua ống sứ đựng 48 gam CuO nung nóng, thu được chất rắn X và giải phóng khí Y. Để tác dụng vừa đủ với chất rắn X cần một thể tích dung dịch HCl 2M là
Hướng dẫn giải
Ta có: nNH3 = 0,2 mol; nCuO = 0,6 mol
CuO + 2NH3 3Cu + N2 + 3H2O
0,3 0,2
nCuO phản ứng = 0,3 mol
→ nCuO dư = 0,3 mol
nHCl = 2nCuO dư = 0,6 mol
→ VHCl = 0,3 lít
Câu 5: Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là bao nhiêu?
Hướng dẫn giải
nCu(OH)2 = 0,2 mol
Cu(OH)2 CuO + H2O
0,2 0,2 mol
CuO + H2 → Cu + H2O
0,2 0,2 mol
→ mCu = 0,2. 64 = 12,8 gam
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 Bài tập về Cấu tạo và tính chất của cacbohiđrat (2024) có đáp án chi tiết nhất
30 Bài tập về Cấu tạo và tính chất của amin, amino axit và protein (2024) có đáp án chi tiết nhất
30 Bài tập về Sự ăn mòn kim loại (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất của kim loại (2024) có đáp án chi tiết nhất
30 Bài tập về Vật liệu polime (2024) có đáp án chi tiết nhất












