Bài tập về Muối Xyanua
I. Lý thuyết và phương pháp giải
1. Khái niệm
Xyanua là tên gọi của gốc muối (C≡N) hay được viết là CN – do có hóa trị I, danh pháp quốc tế là nhóm cyano và hợp chất của nó là Cyanite. Nhóm xyanua bao gồm một nguyên tử cacbon liên kết ba với một nguyên tử nitơ.
2. Tính chất vật lí
- Đặc trưng vật lý dễ nhận biết của các hợp chất xyanua là có mùi hành nhất.
- Hợp chất xyanua có thể tồn tại dưới nhiều hình thức: thể rắn, lỏng, hay khí, xuất hiện ở khắp mọi nơi trong thực phẩm, cây trồng, thậm chí trong thuốc lá hay khói từ nhựa cháy.
- Khí hydro xyanua không màu nhưng có vị đắng như quả hạnh nhân.
3. Tính chất hóa học
- Xyanua là muối của một axit rất yếu (yếu hơn cả axit cacbonic H2CO3) nên dễ bị các axit mạnh hơn đẩy ra khỏi các dung dịch muối của nó. Thí dụ phương trình phản ứng trao đổi của hợp chất muối xyanua với axit mạnh:
2NaCN + H2SO4 → Na2SO4 + 2HCN
- Axit xyanhydric và các hợp chất của xyanua bị oxy hóa bởi oxi trong không khí chuyển thành xyanat:
- Xyanua có thể phản ứng với kim loại và các hợp chất hữu cơ khác (như hợp chất cacbon).
- Ở dung dịch loãng 1⁄5000 trong 5 tháng HCN bị phân hủy hết:
HCN + 2H2O → HCOONH4
2HCN + 2H2S + O2 → 2HCNS + 2H2O
- Các muối xyanua kim loại kiềm bị khí CO2 trong không khí phân hủy tạo thành HCN.
2NaCN + CO2 + H2O → 2HCN + Na2CO3
Vì vậy phải bảo quản muối kim loại cyanide trong thùng kín, để ở chỗ mát.
4. Ứng dụng
- Xyanua có nhiều ứng dụng hữu ích nếu được sử dụng đúng cách. Chẳng hạn, xyanua được sử dụng trong sản xuất giấy, dệt may, nhựa và thuốc trừ sâu.
- Xyanua cũng được sử dụng để chiết xuất vàng, làm cứng sắt và thép, mạ điện và cô đặc quặng bạc. Ngoài ra, hydro xyanua được sử dụng làm chất hun trùng hoặc tác nhân sử dụng trong vũ khí hóa học. Nó thường là một loại khí không màu có thể có mùi hạnh nhân nhẹ.
- HCN - một chất lỏng dễ bay hơi, được sử dụng để điều chế acrylonitril, được sử dụng trong sản xuất sợi acrylic, cao su tổng hợp và chất dẻo.
5. Phương pháp giải bài tập
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh họa
Ví dụ 1. Cho 500ml dung dịch A gồm BaCl2 và MgCl2 phản ứng với 120ml dung dịch Na2SO4 0,5M, đến khi phản ứng xảy ra hoàn toàn thu được 11,65g kết tủa. Lọc bỏ kết tủa đem phần dung dịch cô cạn thu được 16,77g hỗn hợp muối khan. Nồng độ mol/l các chất trong dung dịch A là
A. 0,1M và 0,2M.
B. 0,01M và 0,02M.
C. 0,5M và 0,1M.
D. 0,05M và 0,02M.
Lời giải:
Đáp án A
Cho hỗn hợp A phản ứng với BaCl2 chỉ có Na2SO4 phản ứng.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,05 ← 0,05 ← 0,05 → 0,1 mol
Số mol Na2SO4 còn dư là 0,06 – 0,05 = 0,01 mol
Số mol MgCl2
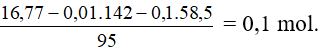
Vậy trong 500ml dd A có 0,05 mol BaCl2 và 0,1 mol MgCl2.
→ Nồng độ của BaCl2 = 0,05/0,5 = 0,1M và nồng độ của MgCl2 =0,1/0,5 = 0,2M.
Ví dụ 2. Trộn 10g dung dịch AgNO3 34% với 10g dung dịch Fe(NO3)2 18% đến khi phản ứng hoàn toàn thấy thu được m gam Ag. Giá trị của m là
A. 5,4 gam.
B. 10,8 gam.
C. 0,54 gam.
D. 1,08 gam.
Lời giải:
Đáp án D
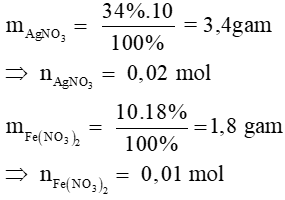
Phương trình phản ứng:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 +Ag (1)
Ta có:
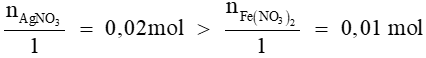
Vậy AgNO3 dư, Fe(NO3)2 hết
Từ (1) có nAg = = 0,01 mol
→ mAg = 0,01.108 = 1,08gam.
III. Bài tập vận dụng
Bài 1. Trộn 2 dung dịch muối nào sau đây sẽ không xuất hiện kết tủa ?
A. BaCl2, Na2SO4.
B. Na2CO3, CaCl2.
C. BaCl2, AgNO3.
D. NaCl, K2SO4.
Lời giải:
Đáp án D
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2NaCl
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
NaCl + K2SO4 → không phản ứng.
Bài 2. Cặp chất nào sau đây không thể tồn tại trong cùng một dung dịch?
A. BaCl2, MgSO4.
B. KCl, Na2SO4
C. CaCl2, NaNO3.
D. ZnSO4, H2SO4
Lời giải:
Đáp án A
BaCl2 và MgSO4 không thể tồn tại trong cùng một dung dịch vì xảy ra phương trình phản ứng:
BaCl2 + MgSO4 → BaSO4 ↓ + MgCl2
Bài 3. Cho Na2CO3 vào từng dung dịch sau: NaCl, BaCl2, Ba(NO3)2, Ca(NO3)2. Số phản ứng xảy ra là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án C
Na2CO3 + NaCl → không phản ứng.
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3.
Bài 4. Cho 20ml dung dịch AgNO3 1M vào lượng dư dung dịch KCl. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
A. 28,7 gam.
B. 2,87 gam.
C. 27,8 gam.
D. 2,78 gam.
Lời giải:
Đáp án B
Ta có: nAgNO3= 0,02.1 = 0,02 mol
Phương trình phản ứng:
AgNO3 + KCl → KNO3 +AgCl ↓
0,02 ………………………….0,02 (mol)
Khối lượng kết tủa tạo thành: mAgCl = 0,02.(108 + 35,5) = 2,87 (g)
Bài 5. Biết 200g dung dịch Na2CO3 10,6% tác dụng vừa đủ với 200 ml dung dịch Ca(NO3)2. Nồng độ dung dịch Ca(NO3)2 đã dùng là
A. 1M.
B. 2M.
C. 0,1M.
D. 0,2M.
Lời giải:
Đáp án A
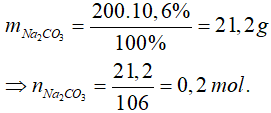
Phương trình hoá học:
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
0,2................0,2 mol
Nồng độ dung dịch Ca(NO3)2 đã dùng là:
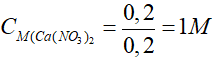
Bài 6. Cho 26,1 gam K2SO4 vào dung dịch chứa 20,8 gam BaCl2, sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 23,3.
B. 2,33.
C. 34,95.
D.3,495.
Lời giải:
Đáp án A
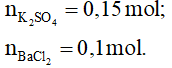
Phương trình hóa học:
K2SO4 + BaCl2 → BaSO4↓ + 2KCl
0,15 0,1 mol
Có
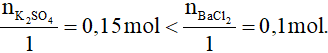
Vậy sau phản ứng BaCl2 hết; số mol kết tủa tính theo BaCl2.
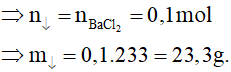
Bài 7. Cho 500ml dung dịch NaCl 0,2M tác dụng với 600ml dung dịch AgNO3 0,2M. Đến khi phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được sau phản ứng là
A. 143,5 gam.
B. 134,5 gam.
C. 14,35 gam.
D. 13,45 gam.
Lời giải:
Đáp án C
nNaCl = 0,5.0,2 = 0,1 mol; nAgNO3= 0,6.0,2 = 0,12 mol
Phương trình hóa học:
NaCl + AgNO3 → AgCl↓ + NaNO3
Xét tỷ lệ
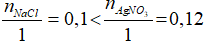
Vậy NaCl phản ứng hết, AgNO3 còn dư.
Ta có: nAgCl = nNaCl = 0,1 mol → mAgCl = 14,35 gam.
Bài 8. Cho 35,4 gam hỗn hợp gồm 2 muối Na2SO4 và Na2CO3 tác dụng hoàn toàn với dung dịch BaCl2 sau phản ứng thu được 62,7 gam kết tủa. Khối lượng mỗi muối trong hỗn hợp ban đầu là
A. 24,2 gam và 11,2 gam.
B. 12,4 gam và 22,1 gam.
C. 20,2 gam và 15,2 gam.
D. 14,2 gam và 21,2 gam.
Lời giải:
Đáp án D
Gọi x và y lần lượt là số mol của Na2SO4 và Na2CO3 trong hỗn hợp ban đầu.
Ta có: 142x + 106y = 35,4 (1)
Phương trình hóa học:
Na2SO4 + BaCl2→ BaSO4 + 2NaCl
x mol …………. x mol
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
y mol…………… y mol
Tổng khối lượng kết tủa là 233x + 197y = 62,7 (2)
Từ (1) và (2) được x = 0,1 mol và y = 0,2 mol
Khối lượng Na2SO4 là 0,1.142= 14,2 gam
Khối lượng Na2CO3 là 0,2.106= 21,2 gam
Xem thêm các dạng bài tập khác:
30 Bài tập về Axit glutamic (2024)
30 Bài tập Anilin tác dụng với dung dịch brom (2024)
30 Bài tập amin tác dụng với axit HCl (2024)




