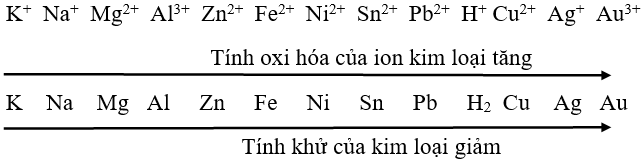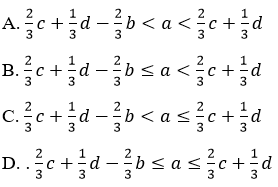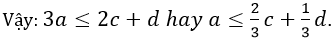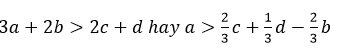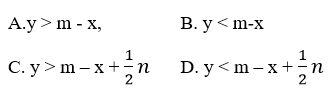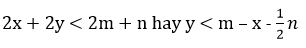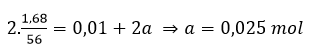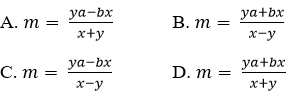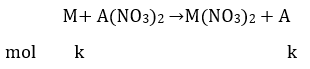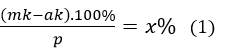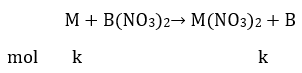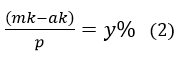Bài tập về Tính chất của kim loại
I. Lý thuyết và phương pháp giải
1. Tính chất chung của kim loại
- Tính chất vật lý: tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim
- Tính chất hóa học: tính khử do nguyên tử kim loại dễ nhường electron trong các phản ứng hóa học.
2. Dãy điện hoá của kim loại
3. Thế điện cực chuẩn của kim loại
- Trong pin điện hóa: Nếu điện cực kim loại là cực âm → thì thế điện cực chuẩn của kim loại có giá trị âm, nếu điện cực kim loại là cực dương → thì thế điện cực chuẩn của kim loại có giá trị dương
- Kim loại của cặp oxi hóa – khử có thế điện cực chuẩn nhỏ hơn có khử được cation kim loại của cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn.
- Quy tắc α: Chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn
2Ag+ + Cu → Cu2+ + 2Ag
Mg + 2H+ → Mg2+ + H2
4. Phương pháp giải
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh họa
Ví dụ 1: Cho các kim loại : Cu, Fe, Ag và các đung dịch HCl, CuSO4, FeCl2, FeO3. Số cặp chất có phản ứng với nhau là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: D
Ví dụ 2: Cho hỗn hợp bột Al và Zn vào dung dịch chứa Cu(NO3)2 và AgNO3 sau phản ứng thu được dung dịch A gồm hai muối và hai kim loại. Hai muối trong dung dịch A là:
A. Zn(NO3)2 và AgNO3. B. Al(NO3)3 và Cu(NO3)2.
C. Al(NO3)3 và Zn(NO3)2. D. Al(NO3)3 và AgNO3.
Đáp án: C
Ví dụ 3: Cho a mol Al và b mol Fe vào dung dịch chứa c mol Cu2+ và d mol Ag+, sau phản ứng thu được chất rắn gồm 3 kim loại. Giá trị của a cần thỏa mãn điều kiện nào sau đây ?
Đáp án: C
Chất rắn gồm 3 kim loại: Ag, Cu và Fe
Các quá trình nhận e có thể xảy ra: Ag+ +1e → Ag
Cu2+ + 2e → Cu
Các quá trình nhường e có thể xảy ra: Al → Al3+ + 3e
Fe → Fe2+ + 2e
Vì Fe dư nên Al đã phản ứng hết, tức là số mol e do Al nhường nhỏ hơn hoặc bằng mol e do Ag+ và Cu2+ có thể nhận.
Dấu “=” xảy ra khi Al phản ứng hoàn toàn và vừa đủ, Fe hoàn toàn chưa phản ứng.
Ag+ có thể nhận. Tức là :
III. Bài tập tự luyện
Bài 1: Cho bột Fe vào dung dịch AgNO3 dư, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các chất tan:
A. Fe(NO3)2, AgNO3, Fe(NO3)3.
B. Fe(NO3)2, AgNO3.
C. Fe(NO3)3, AgNO3.
D. Fe(NO3)2, Fe(NO3)3.
Đáp án: C
Bài 2: Cho Ni từ từ đến dư vào dung dịch hỗn hợp Cu(NO3)2, AgNO3, Mg(NO3)2, Fe(NO3)3 thì thứ tự các ion bị khử là
A. Fe3+, Ag+, Cu2+, Mg2+.
B. Fe3+, Ag+, Cu2+, Mg2+.
C. Ag+, Fe3+, Cu2+, Fe2+
D. Ag+, Fe3+, Cu2+
Đáp án: D
Bài 3: Cho hai thanh kim loại M hóa trị 2 với khối lượng bằng nhau. Nhúng thanh thứ nhất vào dung dịch CuSO4 và thanh thứ hai vào dung dịch Pb(NO3)2 một thời gian, thấy khối lượng thanh thứ nhất giảm và khối lượng thanh thứ hai tăng. Kim loại M là:
A. Mg. B. Ni.
C. Fe. D. Zn.
Đáp án: D
Thanh thứ nhất giảm và thành thứ 2 tăng nên: 64 < M < 207
Chỉ có Zn (65) thỏa mãn
Bài 4: Cho 8,3 gam hỗn hợp X gồm Al, Fe (nAl = nFe) vào 100 ml dung dịch Y gồm Cu(NO3)2 và AgNO3. Sau khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Hòa tan hoàn toàn chất rắn Y vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc) và còn lại 28 gam chất rắn không tan Z. Nồng độ mol của Cu(NO3)2 và của AgNO3 lần lượt là:
A. 2M và 1M.
B. 0,2M và 0,1M.
C. 1M và 2M.
D. 1,5M và 2M.
Đáp án: C
nFe = nAl = 8,3/(27 + 56) = 0,1 mol
Sau phản ứng thu được 3 kim loại Y là: Ag, Cu, Fe dư
Qúa trình cho e: Al → Al3+ + 3e
Fe → Fe2+ + 2e
ne cho = 3nAl + 2nFe = 0,5 mol
nCu2+ = x mol; nAg+ = y mol
Qúa trình nhận e: Ag+ + 1e → Ag
Cu2+ + 2e → Cu
2H+ + 2e → H2
ne nhận = nAg+ + 2 nCu2+ + 2nH2 = 2x + y + 0,1
Bảo toàn e: 2x + y + 0,1 = 0,5 (1)
Chất rắn không tan Z gồm Cu, Ag ⇒ 64x + 108y = 28 gam (2)
Từ (1),(2) ⇒ x = 0,1 mol; y = 0,2 mol
CM Cu(NO3)2 = 1M; CM AgNO3 = 2M
Bài 5: Phát biểu đúng ?
A. Liên kết kim loại là lực hút tĩnh điện giữa các electron tự do gắn các ion dương kim loại với nhau.
B. Lớp ngoài cùng của nguyên tử kim loại thường có từ 1 đến 5 electron.
C. Tính chất vật lí chung của kim loại như: dẻo, dẫn điện, dẫn nhiệt, ánh kim… là do các ion dương kim loại ở các nút mạng tinh thể gây ra.
D. Tất cả các kim loại đều ở trạng thái rắn và có cấu tạo mạng tinh thể.
Đáp án: A
Đáp án B sai vì lớp ngoài cùng của kim loại thường có từ 1 đến 3 electron.
Đáp án C sai vì tính chất vật lí chung của kim loại: dẻo, dẫn điện, dẫn nhiệt, ánh kim là do các electron tự do trong kim loại gây ra.
Đáp án D sai vì ở điều kiện thường Hg ở thể lỏng.
Bài 6: Cho X mol Mg và y mol Zn vào dung dịch chứa m mol Cu2+ và n mol Ag+. Biết rằng x > n/2. Sau phản ứng thu được dung dịch chứa 3 ion kim loại. Giá trị của y cần thỏa mãn điều kiện nào sau đây ?
Đáp án: D
Theo đề bài x > n/2 hay 2x > n. Như vậy: số mol e do Mg nhường lớn hơn số mol e mà Ag+ có thể nhận. Tức là Ag+ đã phản ứng hết.
Sau phản ứng thu được dung dịch chứa 3 ion kim loại là Mg2+, Zn2+, Cu2+ dư
Số mol e do Mg và Zn nhường phải nhỏ hơn tổng số mol e mà Ag+ và Cu2+ có thể nhận.
Ta có:
Bài 7: Cho 1,68 gam bột Fe vào 100 ml dung dịch X gồm AgNO3 0,1M và Cu(NO3)2 xM. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được dung dịch Y và 2,58 gam chất rắn z. Giá trị của x là:
A. 0,23M. B, 0,25M. C. 0,125M. D. 0,1M
Đáp án: C
Xét dung dịch X: có 0,01 mol AgNO3 và 0,1x mol Cu(NO3)2
Xét chất rắn Z ; khối lượng Z lớn hơn khối lượng bạc có thể tạo thành (2,58 > 0,01.108). Vậy trong Z ngoài Ag còn có kim loại khác ( Cu hoặc Cu và Fe).
Các quá trình nhường e: Fe → Fe2+ + 2e
Các quá trình nhận e: Ag+ + 1e → Ag
Cu2+ + 2e → Cu
Trường hợp 1: Z gồm 2 kim loại Ag và Cu, vậy Fe đã phản ứng hết
Gọi số mol Cu2+ đã phản ứng là a.
Bảo toàn e: số mol e do sắt nhường = số mol e do Ag+ và Cu2+ nhận
Mặt khác, khối lượng Z là: 108.0,01 + 64.0.025 = 2,68 ≠2,58. Trường hợp này không xảy ra.
Trường hợp 2: Z gồm 3 kim loại Ag, Cu và Fe. Như vậy Ag+ và Cu2+ đã phản ứng hết, Fe dư.
Gọi số mol sắt đã phản ứng là b.
Bảo toàn e: 2b = 0,01 = 2.0,1x (1)
Mặt khác, khối lượng Z là: 108.0.01 + 64.0,1x + (1,68-56b) = 2,58 (2)
Giải phương trình (1) và (2) ta được: b = 0,0175 và x= 0,125.
Bài 8: Có ba kim loại M, A, B (đều hoá trị II) có khối lượng nguyên tử tương ứng là m, a, b. Nhúng hai thanh kim loại M có cùng khối lượng p gam vào hai dung dịch A(NO3)2 và B(NO3)2 có cùng số mol muối. Sau phản ứng hoàn toàn thấy khối lượng thanh thứ nhất giảm x%, thanh thứ hai tăng y% (so với p). Giả sử các kim loại A, B thoát ra bám hết vào thanh M. Liên hệ giữa m và a, b, x, y là:
Đáp án: D
Gọi số mol kim loại M đã phản ứng trong mối dung dịch là k
Khi nhúng M vào dung dịch A(NO3)2
Khối lượng thanh kim loại giảm:
Khi nhúng M vào dung dịch B(NO3)2 :
Khối lượng thanh kim loại tăng:
Chia từng vế của (1) cho (2) ta được:
Bài 9: Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu , Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là:
A. 205,4 gam và 2,5 mol
B. 199,2 gam và 2,4 mol
C. 205,4 gam và 2,4 mol
D. 199,2 gam và 2,5 mol
Đáp án: C
nY = 13,44 : 22,4 = 0,6 mol
⇒ nNO2 = 0,3 mol; nNO = 0,2 mol; nN2O = 0,1 mol
Viết phương trình nhận e ta có:
ne nhận = nNO2 + 3 nNO + 8 nN2O = 1,7 mol
nNO3- muối = ne nhận = 1,7 mol
m = mX + nNO3- muối = 100 + 1,7. 62 = 205,4 gam
Bảo toàn nguyên tố N: nHNO3 = nN = nNO3- muối + nNO2 + nNO + 2nN2O
⇒ nHNO3 = 2,4 mol
Bài 10: Hãy sắp xếp các cặp oxi hóa khử sau đây theo thứ tự tăng dần tính oxi hóa của các ion kim loại. (1): Fe2+/Fe; (2): Pb2+/Pb; (3): 2H+/H2; (4): Ag+/Ag; (5): Na+/Na; (6): Fe3+/Fe2+; (7): Cu2+/Cu
A. (5) < (1) < (2) < (3) < (7) < (6) < (4)
B. (4) < (6) < (7) < (3) < (2) < (1) < (5)
C. (5) < (1) < (6) < (2) < (3) < (4) < (7)
D. (5) < (1) < (2) < (6) < (3) < (7) < (4)
Đáp án: A
Bài 11: Cation X2+ có cấu hình electron phân lớp ngoài cùng là 3p6. Hãy xác định vị trí của nguyên tố X trong bảng hệ thống tuần hoàn.
A. Nhóm IIA, chu kì 4
B. Nhóm IIIA, chu kì 4
C. Nhóm IIIA, chu kì 2
D. Nhóm IIA, chu kì 6
Lời giải:
Đáp án: A
Từ X → X2+ + 2e ⇒ R có cấu hình electron là:1s22s22p63s23p64s2: có 4 lớp electron nên thuộc chu kì 4; có electron cuối cùng thuộc phân lớp s nên thuộc nhóm A và có 2 electron hóa trị nên thuộc nhóm II.
Bài 12: Có thể dùng axit nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Ag?
A. HCl
B. HNO3 loãng
C. H2SO4 loãng
D. H2SO4 đặc nguội.
Lời giải:
Đáp án: B
Bài 13: Phản ứng nào sau đây chứng tỏ Fe2+ có tính khử yếu hơn so với Cu?
A. Fe + Cu2+ → Fe2+ + Cu .
B. Fe2+ + Cu → Cu2+ + Fe.
C. 2Fe3+ + Cu → 2Fe2+ + Cu2+.
D. Cu2+ + 2Fe2+ → 2Fe3+ + Cu.
Lời giải:
Đáp án: C
Bài 14: Cho 2 phương trình ion rút gọn
M2+ + X → M + X2+
M + 2X3+ → M2+ + 2X2+
Nhận xét nào sau đây là đúng?
A. Tính khử: X > X2+ > M.
B. Tính khử: X2+ > M > X.
C. Tính oxi hóa: M2+ > X3+ > X2+.
D. Tính oxi hóa: X3+ > M2+ > X2+.
Lời giải:
Đáp án: D
Bài 15: Có thể dùng dung dịch muối nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Cu?
A. Cu(NO33)2
B. Pb(NO3)2
C. AgNO3
D. Al(NO3)3
Lời giải:
Đáp án:C
Bài 16: Hầu hết kim loại đều có ánh kim vì
A. Các ion dương trong kim loại hấp thụ tốt những tia sáng có bước sóng mà mắt ta có thể thấy được.
B. Kim loại có cấu trúc mạng tinh thể nên dễ hấp thụ các tia sáng.
C. Mây electron tự do trong kim loại đã phản xạ tốt các tia sáng có bước sóng mà mắt ta thấy được.
D. Tinh thể kim loại đa số ở thể rắn, có hình thể đồng nhất nên phản xạ tốt các tia sáng chiếu tới tạo vẻ sáng lấp lánh.
Lời giải:
Đáp án: C
Bài 17: Chất nào cứng nhất?
A. Cr
B. W
C. Ti
D. Kim cương
Lời giải:
Đáp án: D
Bài 18: Có dung dịch FeSO4 lẫn CuSO4. Phương pháp đơn giản nhất để loại tạp chất là:
A. Cho 1 lá đồng vào dung dịch
B. Cho 1 lá sắt vào dung dịch
C. Cho 1 lá nhôm vào dung dịch
D. Cho dung dịch NH3 đến dư vào dung dịch, lọc lấy kết tủa Fe(OH)2 rồi hòa tan tủa vào dung dịch H2SO4 loãng.
Lời giải:
Đáp án: B
Bài 19: Tính chất chung của ăn mòn điện hóa và ăn mòn hóa học là:
A. Có phát sinh dòng điện
B. Electron của kim loại được chuyển trực tiếp sang môi trường tác dụng
C. Nhiệt độ càng cao tốc độ ăn mòn càng nhanh.
D. Đều là các quá trình oxi hóa - khử.
Lời giải:
Đáp án: D
Bài 20: Chất nào sau đây có thể oxi hóa Zn thành Zn2+?
A. Fe
B. Ag+
C. Al3+
D. Ca2+
Lời giải:
Đáp án: B
Bài 21: Dùng phản ứng của kim loại với dung dịch muối không thể chứng minh
A. Cu có tính khử mạnh hơn Ag.
B. Cu2+ có tính oxi hóa mạnh hơn Zn2+.
C. Fe3+ có tính oxi hóa mạnh hơn Fe2+.
D. K có tính khử mạnh hơn Ca.
Lời giải:
Đáp án: D
Bài 22: Điểm khác nhau giữa kim loại và hợp kim.
A. Kim loại là đơn chất . Hợp kim là hỗn hợp hay hợp chất
B. Kim loại có điểm nóng chảy cố định. Hợp kim có điểm nóng chảy thay đổi tuỳ theo thành phần.
C. Kim loại dẫn điện . Hợp kim không dẫn điện
D. A,B đều đúng
Lời giải:
Đáp án: D
Bài 23: Nhận xét nào về tính chất vật lí của kim loại dưới đây là không đúng ?
A. Nhiệt độ nóng chảy : Hg < Al < W.
B. Tính cứng : Cs < Fe < W < Cr
C. Tính dẫn điện và nhiệt: Fe < Al < Au < Cu < Ag.
D. Tính dẻo : Al < Au < Ag.
Đáp án: D
Tính dẻo Al < Ag < Cu
Bài 24: Cho các phản ứng sau :
X + HNO3(đặc, nóng) → A + NO2 + H2O
A + Cu → X + D
X có thể là kim loại nào trong số các kim loại sau ?
A. Zn B. Fe C. Pb D. Ag
Đáp án: D
Đông đẩy được X ra khỏi muối nên X là Ag
Xem thêm các dạng bài tập hay khác:
30 Bài tập về Sự ăn mòn kim loại (2024) có đáp án chi tiết nhất
70 Bài tập Tính chất của kim loại. Dãy điện hóa của kim loại (2024) có đáp án chi tiết nhất
1000 Bài tập hóa 12 Chương 5: Đại cương về kim loại (có đáp án năm 2023)
30 Bài tập về Hợp kim của sắt (2024) có đáp án chi tiết nhất
70 Bài tập về Điều chế kim loại (2024) có đáp án chi tiết nhất