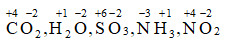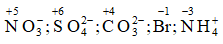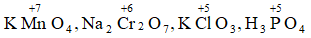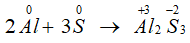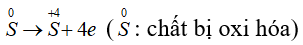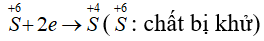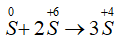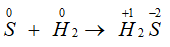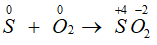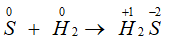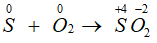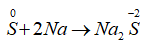Bài tập Xác định số oxi hóa của lưu huỳnh (S) trong hợp chất
I. Lí thuyết
1. Vị trí và cấu hình
- Nguyên tử lưu huỳnh có số hiệu nguyên tử là 16, thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn các nguyên tố hóa học.
- Nguyên tử lưu huỳnh có cấu hình electron: 1s22s22p63s23p4. Lớp ngoài cùng có 6 electron.

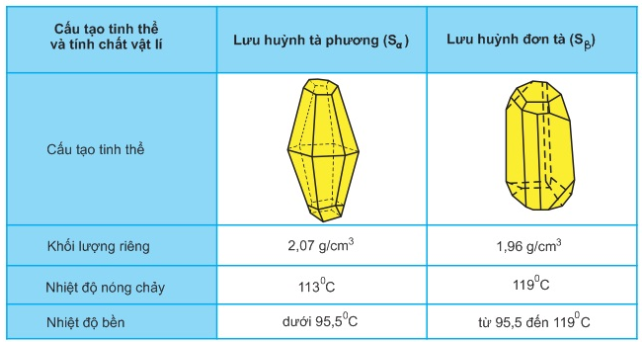
2. Tính chất vật lí
- Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
- Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau. Hai dạng thù hình có thể biến đổi qua lại với nhau tùy theo điều kiện nhiệt độ.
3. Tính chất hóa học
Lưu huỳnh trong hợp chất có các số oxi hóa -2; +4; +6. Như vậy khi tham gia phản ứng hóa học số oxi hóa của lưu huỳnh có thể tăng hoặc có thể giảm. Ta nói, lưu huỳnh có tính oxi hóa và tính khử.
a. Tác dụng với kim loại và hiđro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro tạo thành khí hiđrosunfua:
H2 + S H2S
- Tác dụng với kim loại tạo thành muối sunfua:
Fe + S FeS
Zn + S ZnS

Bột sắt tác dụng với bột lưu huỳnh
Chú ý: Lưu huỳnh có thể phản ứng với thủy ngân ngay điều kiện thường:
Hg + S → HgS
b. Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa
- Tác dụng với phi kim:
S + O2 SO2
S + 3F2 SF6

Lưu huỳnh cháy trong oxi
- Tác dụng với các chất có tính oxi hóa mạnh
S + 2H2SO4 đặc 3SO2 + 2H2O
S + 4HNO3 đặc 2H2O + 4NO2 + SO2
II. Phương pháp xác định số oxi hóa
- Quy tắc 1 : Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
Ví dụ : Số oxi hóa của các nguyên tố Na, Fe, H, O, Cl trong đơn chất tương ứng Na, Fe, H2, O2, Cl2 đều bằng 0.
- Quy tắc 2 : Trong hầu hết các hợp chất :
Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
- Quy tắc 3 : Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
- Quy tắc 4 : Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
Ví dụ : Số oxi hóa của Na, Zn, S và Cl trong các ion Na+, Zn2+, S2-, Cl- lần lượt là : +1, +2, –2, –1.
Tổng đại số số oxi hóa của các nguyên tố trong các ion SO42-, MnO4-, NH4+ lần lượt là : –2, –1, +1.
Chú ý: Để biểu diễn số oxi hóa thì viết dấu trước, số sau, còn để biểu diễn điện tích của ion thì viết số trước, dấu sau.
Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -) thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ (+1 hoặc –1).
Trong hợp chất, kim loại kiềm, kiềm thổ, nhôm luôn có số oxi hóa lần lượt là : +1, +2, +3.
III. Ví dụ minh họa
Ví dụ 1: Số oxi hoá của nguyên tố lưu huỳnh trong các chất : S, H2S, H2SO4, SO2 lần lượt là:
A. 0, +2, +6, +4.
B. 0, –2, +4, –4.
C. 0, –2, –6, +4.
D. 0, –2, +6, +4.
Lời giải:
Đáp án D.
Gọi số oxi hóa của S là x
Ví dụ 2: Số oxi hóa của S trong hợp chất KAl(SO4)2 là
A. -2.
B. +2.
C. +4.
D. +6.
Lời giải:
Đáp án D
Gọi số oxi hóa của S trong hợp chất KAl(SO4)2 là x.
Ta có: (+1) + (+3) + 2×[x +4×(-2)] = 0 x = +6.
Vậy số oxi hóa của S trong hợp chất KAl(SO4)2 là +6.
Ví dụ 3: Vị trí của nguyên tố lưu huỳnh (z = 16) trong bảng tuần hoàn hóa học là
A. Ô thứ 16, chu kì 3, nhóm VIA.
B. Ô thứ 16, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm IVA.
D. Ô thứ 16, chu kì 2, nhóm IVA.
Lời giải:
Đáp án A.
Cấu hình electron của lưu huỳnh: 1s22s22p63s23p4
Lưu huỳnh thuộc ô thứ 16 (do z = 16), chu kỳ 3 (do có 3 lớp electron), nhóm VIA (do có 6e lớp ngoài cùng, nguyên tố p).
Ví dụ 4: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na.
B. Cl.
C. O.
D. S.
Lời giải:
Đáp án D.
Cấu hình của X: 1s22s22p63s23p4.
→ X thuộc ô 16, chu kỳ 3, nhóm VIA. X là lưu huỳnh (S).
Ví dụ 5: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
A. 0, 2, 4, 6.
B. -2, 0, +4, +6.
C. 1, 3, 5, 7.
D. -2, +4, +6.
Lời giải:
Đáp án D.
Ở trạng thái cơ bản S có 2 electron độc thân, ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Do đó trong hợp chất S có thể thể hiện các số oxi hóa -2, +4, +6.
IV. Bài tập vận dụng
Bài 1: Số oxi hóa của S trong H2SO4 là
A. +4.
B. +6.
C. –2.
D. 0.
Lời giải:
Đáp án B
Gọi số oxi hóa của S trong H2SO4 là x.
Số oxi hóa của H trong hợp chất là +1; của O là –2.
Tổng các số oxi hóa của các phân tử trong hợp chất bằng 0.
2×(+1) + x + 4×(-2) = 0 x = +6.
Vậy S có số oxi hóa +6 trong H2SO4.
Bài 2: Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Lời giải:
Áp dụng quy tắc xác định số oxi hóa:
+) Phân tử:
+) Ion: Số oxi hóa của Na+ , Cu2+, Fe2+ , Fe3+, Al3+ lần lượt là: +1, +2, +2, +3, +3
Bài 3: Hãy xác định số oxi hóa của các nguyên tố:
- Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
- Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
- Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
- Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
- Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
Lời giải:
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2.(-2) = 0 → x = +4.
Trong N2O5: 2x + 5.(-2) = 0 → x = +5.
Trong HNO3: (+1) + x + 3.(-2) = 0 → x = +5.
Trong HNO2: (+1) + x +2.(-2) = 0 → x = +3.
Trong NH3 : x + 3.(+1) = 0 → x = -3.
Trong NH4Cl: x + 4.(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:
Số oxi hóa của Cl trong:
Số oxi hóa của Mn trong :
Số oxi hóa của Cr trong :
Số oxi hóa của S trong :
Bài 4: Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42- ; CO32- , Br, NH4+
Lời giải:
Số oxi hóa của N, S, C, Br:
Bài 5: Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Lời giải:
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
Bài 6: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Lời giải:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Bài 7: Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4 , Na2Cr2O7, KClO3, H3PO4
Lời giải:
Số oxi hóa của Mn, Cr, P:
Bài 8: Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với chất nào dưới đây?
A. O2.
B. Al.
C. H2SO4 đặc.
D. F2.
Lời giải:
Đáp án B.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Bài 9: Cho phản ứng: S + 2H2SO4(đặc) → 3SO2↑ + 2H2O. Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Lời giải:
Đáp án D.
Quá trình khử:
Quá trình oxi hóa:
PTSC:
→ Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là 2 : 1.
Bài 10: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3 B. 3 và +5
C. 5 và +5 D. 3 và -3
Lời giải:
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Bài 11: Số oxi hoá của nguyên tố nitơ trong các hợp chất : NH4Cl, HNO3, NO, NO2, N2,N2O lần lượt là :
A. - 4, +6, +2, +4, 0, +1
B. 0, +1,–4, +5, –2, 0
C. -3, +5, +2,+4, 0,+1
D. 0, +1.+3, –5, +2, –4
Đáp án C.
Gọi số oxi hóa của N là x, số oxi hóa trong hợp chất của H =+1, O = -2.
Bài 12: Số oxi hóa của nitơ trong NH4+ , NO2-, và HNO3 lần lượt là:
A. +5, -3, +3
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3
Đáp án B
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+ , NO2-, và HNO3
Ta có:
x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+ là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
Bài 14: Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2.
B. O3.
C. S.
D. O2.
Lời giải:
Đáp án C.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Bài 15: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
A. Lưu huỳnh không có tính oxi hoá, tính khử.
B. Lưu huỳnh chỉ có tính oxi hoá.
C. Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử.
D. Lưu huỳnh chỉ có tính khử.
Lời giải:
Đáp án C
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Bài 16: Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hóa?
A. S + O2 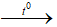
B. S + 2Na 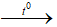
C. S + 2H2SO4(đ) 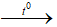
D. S + 6HNO3(đ) 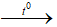
Lời giải:
Đáp án B
Xem thêm các dạng bài tập Hóa học hay khác:
30 Bài tập Xác định số oxi hóa của Nitơ (N) trong hợp chất (2024) có đáp án
30 Bài tập Xác định số oxi hóa của Sắt (Fe) trong hợp chất (2024) có đáp án
30 Bài tập xác định số oxi hóa của Clo (Cl) trong hợp chất (2024) có đáp án