Bài tập về Fe(NO3)3 hay nhất
I. Lí thuyết và phương pháp giải
1. Định nghĩa
- Định nghĩa: Sắt(III) nitrat là một hợp chất với công thức hóa học Fe(NO3)3. Có khả năng hút ẩm tốt nên thường được tìm thấy ở dạng tinh thể ngậm 9 nước Fe(NO3)3•9H2O với màu sắc từ không màu cho đến màu tím nhạt.
- Công thức phân tử: Fe(NO3)3
2. Tính chất hóa học
- Tính chất hóa học của muối.
- Có tính oxi hóa: Khi tác dụng với chất khử, hợp chất sắt (III) clorua bị khử thành hợp chất sắt (II) hoặc kim loại sắt tự do.
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
a. Tính chất hóa học của muối:
- Tác dụng với dung dịch kiềm:
3Ca(OH)2 + 2Fe(NO3)3 → 3Ca(NO3)2 + 2Fe(OH)3
3NaOH + Fe(NO3)3 → 3NaNO3 + Fe(OH)3
3H2O + 3NH3 + Fe(NO3)3 → 3NH4NO3 + Fe(OH)3
b. Tính oxi hóa
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
3Mg + 2Fe(NO3)3 → 2Fe + 3Mg(NO3)2

3. Tính chất vật lí và nhận biết
Tính chất vật lí:
- Tan tốt trong nước, thường tồn tại ở dạng tinh thể ngậm nước.
- Nhiệt độ nóng chảy: 47,2độC.
Nhận biết: Thông qua màu sắc ion Fe3+ khi phản ứng với dung dịch bazơ, tạo kết tủa màu nâu đỏ:
Fe(NO3)3 + 3NaOH → Fe(OH)3 ↓ + NaNO3
4. Điều chế
- Muối sắt(III) nitrat được hình thành do phản ứng của bột kim loại sắt hoặc oxit sắt với axit nitric.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.
- Trong công nghiệp:
4Fe + 12HNO3 + 3O2 → 4Fe(NO3)3 + 6H2O.
- Trong phòng thí nghiệm: Sử dụng phản ứng trao đổi:
Fe2(SO4)3 + 3Ba(NO3)2 → 2Fe(NO3)3 + 6H2O
5. Phương pháp giải
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh họa
Ví dụ 1: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên?
A. Zn.
B. Fe.
C. Mg.
D. Ag.
Hướng dẫn giải:
Đáp án B
Sử dụng một lượng dư kim loại sắt.
Fe + CuCl2 → FeCl2 + Cu ↓
Lọc bỏ kim loại thu được FeCl2 tinh khiết.
Ví dụ 2. Nhúng một lá sắt vào dung dịch đồng sunfat sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,4g. Khối lượng đồng bám vào lá sắt là
A. 0,2g.
B. 1,6g.
C. 3,2g.
D. 6,4g.
Hướng dẫn giải :
Đáp án C
Fe + CuSO4 → FeSO4 + Cu
x…………………………x mol
Khối lượng lá sắt tăng = mCu sinh ra – mFe phản ứng
→ 64x – 56x = 0,4 → x = 0,05 mol
mCu sinh ra = 64.0,05 = 3,2 gam.
Ví dụ 3. Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axit đã phản ứng là
A. 32%.
B. 54%.
C. 19,6%.
D. 18,5%.
Hướng dẫn giải:
Đáp án C
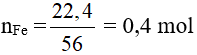
Fe + H2SO4→ FeSO4 + H2
0,4 → 0,4 mol
maxit = 0,4.98 = 39,2 gam
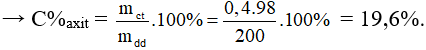
III. Bài tập vận dụng
Bài 1: Sắt không phản ứng với chất nào sau đây?
A. Cl2.
B. HCl.
C. CuSO4.
D. NaOH.
Lời giải:
Đáp án D
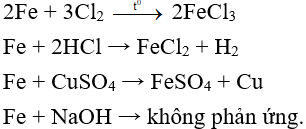
Bài 2: Cho 0,83 gam hỗn hợp gồm nhôm và sắt tác dụng với H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc. Phần trăm khối lượng của sắt trong hỗn hợp ban đầu là
A. 67,47%.
B. 47,67%.
C. 32,53%.
D. 50,00%.
Lời giải:
Đáp án A
Gọi số mol của Al và Fe lần lượt là x và y mol.
Ta có: mhh = 0,83 gam → 27x + 56y = 0,83 (1)
Phương trình hóa học:
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
x……………………………………1,5x mol
Fe + H2SO4loãng → FeSO4 + H2
y…………………………….y mol
Theo PTHH có nkhí = 1,5x + y = 0,025 (2)
Từ (1) và (2) có x = y = 0,01.
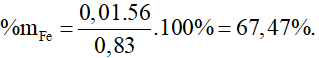
Bài 3. Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ thu được dung dịch X. Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch X có hiện tượng xảy ra là
A. Có khí bay ra và dung dịch có màu xanh lam.
B. Không thấy hiện tượng gì.
C. Xuất hiện kết tủa trắng xanh rồi chuyển dần thành màu nâu đỏ.
D. Có khí thoát ra và tạo kết tủa màu xanh.
Lời giải:
Đáp án C
Fe + 2HCl → FeCl2 + H2↑
2NaOH + FeCl2 → Fe(OH)2 (↓ trắng xanh) + 2NaCl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (↓ nâu đỏ).
Như vậy khi nhỏ từ từ đến dư NaOH vào dung dịch X (FeCl2) sẽ thu được kết tủa trắng xanh Fe(OH)2, sau đó kết tủa dần chuyển sang màu nâu đỏ do trong không khí Fe(OH)2 bị oxi hóa thành Fe(OH)3.
Bài 4. Cho vào dung dịch HCl một cây đinh sắt , sau một thời gian thu được 11,2 lít khí hiđro (đktc). Khối lượng sắt đã phản ứng là
A. 28 gam.
B. 12,5 gam.
C. 8 gam.
D. 36 gam.
Lời giải:
Đáp án A
nkhí = 0,5 mol
Fe + 2HCl → FeCl2 + H2
0,5 ………………….0,5 mol
→ mFe = 0,5.56 = 28 gam.
Bài 5. Hòa tan hoàn toàn 21,6 gam hỗn hợp bột: Fe, Fe2O3 bằng lượng dư dung dịch HCl thấy thoát ra 2,24 lít H2 ( đktc).Thành phần phần trăm khối lượng của Fe2O3 trong hỗn hợp ban đầu là
A. 25,93%.
B. 74,07%.
C. 29,53%.
D. 70,74%.
Lời giải:
Đáp án B
PTHH:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (1)
Fe + 2HCl → FeCl2 + H2 (↑) (2)
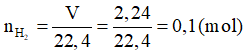
Theo PTHH (2) có: nFe = nkhí = 0,1 mol
→ mFe = n.M = 0,1.56 = 5,6 gam.
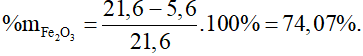
Bài 6: Dẫn khí CO quan m gam bột Fe2O3 nung nóng, sau một thời gian thu được 24 gam chất rắn X và hỗn hợp khí Y. Dẫn khí Y vào dung dịch nước vôi trong dư thu được 30 gam kết tủa. Giá trị của m là
A. 26,4g.
B. 28,8g.
C. 23,2g.
D. 33,6g.
Lời giải:
Đáp án B
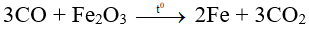
0,3………………………..0,3 mol
CO2 + Ca(OH)2 dư → CaCO3 (↓) + H2O
0,3 …………………..0,3 mol
Bảo toàn khối lượng có: mCO pư + mFe2O3 = mCO2 + mcr X
→ 0,3.28 + m = 0,3.44 + 24 → m = 28,8 gam.
Bài 7: Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Vậy khối lượng Ag sinh ra là
A.10,8 gam.
B. 21,6 gam.
C.1,08 gam.
D. 2,16 gam.
Lời giải:
Đáp án D
Fe dư, nên có phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
a……………………………..2a mol
mcr tăng = mAg sinh ra – mFe pư
→ 57,6 – 56 = 108.2a – 56a → a = 0,01 mol
→ mAg = 2.0,01.108 = 2,16 gam.
Bài 8. Hòa tan 12,8 gam hỗn hợp gồm Fe, FeO bằng dd HCl vừa đủ, thu được 2,24 lít (đktc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là
A. 56,25%.
B. 43,75%.
C. 66,67%.
D. 33,33%.
Lời giải:
Đáp án A
nHCl = 0,1 (mol)
Fe +2HCl → FeCl2 + H2
0,1…………………..0,1 (mol)
Vậy mFe = 0,1.56 = 5,6 (g)
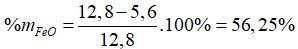
Bài 9: Cho m gam Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc). Giá trị của m là
A. 16,8 gam.
B. 1,68 gam.
C. 1,12 gam.
D.11,2 gam.
Lời giải:
Đáp án D
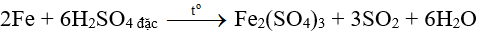
0,2..................................................................0,3 mol
Vậy mFe = 0,2.56 = 11,2 lít.
Bài 10. Đun nóng hỗn hợp gồm 5,6 gam bột sắt và 1,6 gam lưu huỳnh trong bình kín (giả sử phản ứng xảy ra hoàn toàn) thu được m (gam) hỗn hợp chất rắn X. Giá trị của X là
A. 7,2.
B. 4,4.
C. 2,8.
D. 3,6.
Lời giải:
Đáp án A
Bảo toàn khối lượng:
msau = mtrước = 5,6 + 1,6 = 7,2 gam.
Xem thêm các dạng bài tập Hóa học hay khác:
30 Bài tập về tốc độ phản ứng hóa học (2024) hay, có đáp án
30 Bài tập tính nguyên tử khối trung bình (2024) có đáp án
30 Bài tập về đơn chất và hợp chất, phân tử (2024) có đáp án
30 Câu trắc nghiệm lý thuyết este (2024) hay, có đáp án
30 Bài tập Xác định số oxi hóa của Nitơ (N) trong hợp chất (2024) có đáp án




