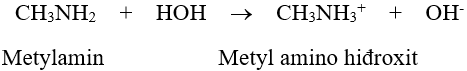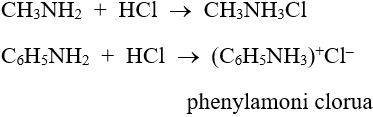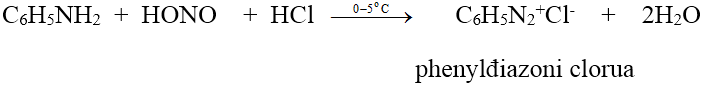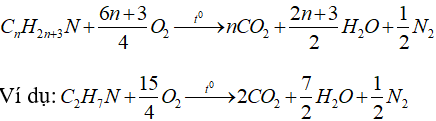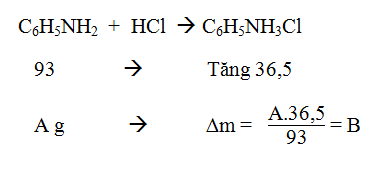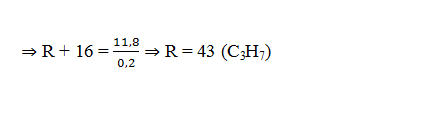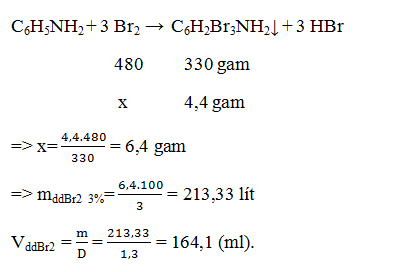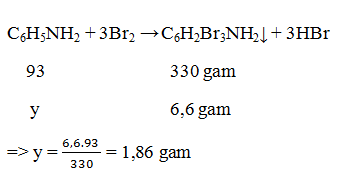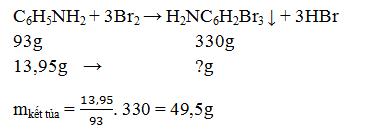Bài tập amin tác dụng với axit HCl
I. Lý thuyết
1. Tính chất hoá học của amin
a. Tính bazơ
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2
- Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
– Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ ⇒ tính bazơ yếu ⇒ dung dịch không làm đổi màu quỳ tím và phenolphtalein.
- Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổ màu quỳ tím và phenolphtalein.
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa:
Ví dụ: 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
- Lưu ý: Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) → hiđroxit kết tủa → kết tủa tan (tạo phức chất).
b. Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni:
c. Phản ứng ankyl hóa
Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …) , nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
– Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
d. Phản ứng thế ở nhân thơm của anilin
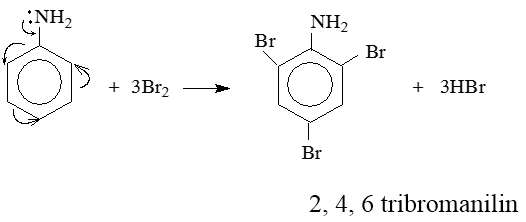
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom:
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin.
e) Phản ứng cháy của amin no đơn chức mạch hở:
2. Phương pháp giải
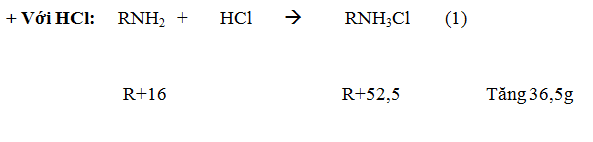
1) Áp dụng định luật bảo toàn khối lượng: mamin + maxit = mmuối
2) Tính mol của chất đề bài cho rồi đặt vào phương trình để suy ra số mol của chất đề bài hỏi ⇒ tính m
3) Áp dụng định luật tăng giảm khối lượng
⇒ mMuối = A + B
II. Ví dụ minh họa
Ví dụ 1: Cho 35 gam hỗn hợp các amin gồm anilin; metylamin; đimetylamin; đimetylmetylamin tác dụng vừa đủ với 300 ml dung dịch HCl 1M. Tính khối lượng muối khan thu được sau phản ứng?
Giải
Tổng quát: RN + HCl → RNHCl
nHCl = 0,3 mol
Bảo toàn khối lượng ta có:
mmuối khan = mAmin + 36,5nHCl = 35+ 36,5. 0,3 = 45,95 gam
Ví dụ 2:Cho 12,1 gam hỗn hợp X gồm metylamin, đimetylamin (tỉ lệ mol 1: 2) phản ứng vừa đủ với 300 ml dung dịch HCl 1M, thu được m gam muối. Giá trị của m là:
Giải
Có: nCH3NH2 = 0,1 ; n(CH3)2NH = 0,2 mol
nHCl = 0,3 mol
Tổng quát: RN + HCl → RNHCl
⇒ mmuối = mamin + mHCl = 0,1. 31+0,2. 45+ 0,3. 36,5=23,05g
Ví dụ 3:Cho 0,1 mol anilin (C6H5-NH2) tác dụng vừa đủ với dung dịch HCl. Khối lượng muối phenylamoni clorua thu được là:
Giải
⇒ nmuối = 0,1 mol ⇒ mmuối = 0,1 .129,5 = 12,95g
III. Bài tập vận dụng
Bài tập 1 : Cho các chất sau:
(1). Amoniac
(2). Anilin
(3). p – Nitroanilin
(4). p – Metyanilin
(5). Metylamin
(6). Đimetylamin
Tính bazơ tăng dần của cac chất được sắp xếp theo dãy nào sau đây?
A. (3) < (2)< (4) < (1) < (5) < (6)
B. (3) < (4) < (2) < (1) < (5) < (6)
C. (6) < (5) < (1) < (4) < (2) < (3)
D. (5) < (4) < (2) < (1) < (3) < (6)
Hướng dẫn giải :
- Vòng benzen hút electron mạnh hơn nguyên tử H nên các amin thơm có tính bazơ yếu hơn NH3
- Gốc metyl –CH3 đẩy e mạnh hơn nguyên tử H nên các amoin có nhóm –CH3 có tính bazơ mạnh hơn NH3; và đimetyl amin có tính bazơ mạnh hơn metylamin ⇒ (1) < (5) < (6)
- Trong các amin thơm, nhóm -NO2 có liên kết đôi là nhóm hút e nên làm giảm lực bazơ, nhóm metyl –CH3 là nhóm đẩy e nên làm tăng lực bazơ (3) < (2)< (4) < (1)
→ Đáp án A
Bài tập 2 : Cho các chất: (1) amoniac; (2) metylamin; (3) anilin; (4) dimetylamin. Tính bazơ tăng dần theo thứ tự nào sau đây?
A. (1) < (3) < (2) < (4).
B. (3) < (1) < (2) < (4).
C. (1) < (2) < (3) < (4).
D. (3) < (1) < (4) < (2).
Hướng dẫn giải :
Amoniac(NH3); metyamin (CH3NH2); anilin( C6H5NH2); dimetyl amin(CH3 – NH – CH3)
Dựa vào tính chất trên: anilin có vòng benzen(gốc phenyl) ⇒ Tính bazơ yếu nhất
NH3 ở mức trung gian > C6H5NH2
Amin bậc I (CH3NH2) < Amin bậc 2 (NH3 – NH –NH3)
⇒Thứ tự: C6H5NH2 < CH3 < CH3NH2<(CH3)2NH
→ Đáp án B
Bài tập 3: Cho 4,5 gam etylamin tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là:
A. 7,65 gam.
B. 8,10 gam.
C. 8,55 gam.
D. 8,15 gam.
Lời giải:
Ta có: nC2H5NH2 = 0,1 mol
C2H5NH2 + HCl → C2H5NH3Cl
0,1 mol → 0,1 mol
⇒ mmuối = 8,15 g
→ Đáp án D
Bài tập 4:Cho 5,9 gam propylamin (C3H7NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là:
A. 9,65 gam.
B. 8,15 gam.
C. 9,55 gam.
D. 8,10 gam.
Lời giải:
Ta có: nC3H7NH2 =0,1 mol
C3H7NH2 + HCl → C3H7NH3Cl
0,1 mol → 0,1 mol
⇒ mmuối =9,55g
→ Đáp án C
Bài tập 5:Cho 11,8 gam amin đơn chức X tác dụng vừa đủ với dung dịch HCl, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 19,1 gam muối khan. Số công thức cấu tạo ứng với công thức phân tử của X là
A.2
B. 3
C. 4
D.5
Lời giải:
Đặt CT của amin đơn chức là RNH2
RNH2 + HCl → RNH3Cl
⇒ mtăng = mHCl phản ứng = 7,3g ⇒ nHCl = namin = 0,2 mol
⇒ X là C3H7NH2 có 4 CTCT thỏa mãn:
CH3CH2CH2NH2; CH3CH(NH2)CH3 ; CH3CH2NHCH3; CH3NH(CH3)C H3
→ Đáp án C
Bài tập 6:Cho m gam Anilin tác dụng hết với dung dịch Br2 thu được 9,9 gam kết tủa. Giá trị m đã dùng là
A. 0,93 gam
B. 2,79 gam
C. 1,86 gam
D. 3,72 gam
Lời giải:
C6H5-NH2 + 3Br2 → C6H2Br3NH2 kết tủa + 3HBr.
⇒ n kết tủa = 0,03 mol.
⇒ nAnilin = n kết tủa = 0,03 mol.
⇒ m = 0,03.93 = 2,79g
→ Đáp án B
Bài tập 7: Tính thể tích nước brom 3% (D = 1,3 g/ml) cần dùng để điều chế 4,4 gam tribromanilin.
A. 164,1ml.
B. 49,23ml.
C 88,61 ml.
D. số khác .
Lời giải:
→ Đáp án A
Bài tập 8: Tính khối lượng anilin có trong dung dịch A. Biết khi cho A tác dụng với nước brom thì thu được 6,6 gam kết tủa trắng.
A. 2,79 gam
B. 1,86 gam
C. 3,72 gam
D. 0,93 gam
Lời giải:
→ Đáp án B
Bài tập 9:Cho m gam etylamin tác dụng vừa đủ với 200 ml dung dịch H2SO4 1M thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là
A. 9,0.
B. 18,0.
C. 4,5.
D. 13,5.
Lời giải:
Muối gồm (C2H5NH3)2SO4 (a mol) và C2H5NH3HSO4 (a mol)
nH2SO4 = a + a = 0,2 ⇒ a = 0,1
nC2H5NH2 = 2a + a = 0,3 ⇒ m = 45.0,3 = 13,5g
→ Đáp án D
Bài tập 10: Cho 13,95 gam anilin tác dụng với nước brom thu được m gam kết tủa trắng. Giá trị của m là:
A. 74,25 gam.
B. 49,5 gam.
C. 45,9 gam.
D. 24,75 gam.
Lời giải:
→ Đáp án B
Câu 11: Cho 4,5 gam etylamin tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là:
A. 7,65 gam.
B. 8,10 gam.
C. 8,55 gam.
D. 8,15 gam.
Ta có: = 0,1 mol
C2H5NH2 + HCl → C2H5NH3Cl
0,1 mol → 0,1 mol
⇒ mmuối = 8,15 g
→ Đáp án D
Câu 12: Cho 5,9 gam propylamin (C3H7NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là:
A. 9,65 gam.
B. 8,15 gam.
C. 9,55 gam.
D. 8,10 gam.
Ta có: =0,1 mol
C3H7NH2 + HCl → C3H7NH3Cl
0,1 mol → 0,1 mol
⇒ mmuối = 9,55g
→ Đáp án C
Câu 13: Cho 11,8 gam amin đơn chức X tác dụng vừa đủ với dung dịch HCl, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 19,1 gam muối khan. Số công thức cấu tạo ứng với công thức phân tử của X là
A. 2
B. 3
C. 4
D. 5
Đặt CT của amin đơn chức là RNH2
RNH2 + HCl → RNH3Cl
⇒ mtăng = mHCl phản ứng = 7,3g ⇒ nHCl = namin = 0,2 mol
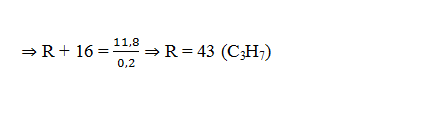
⇒ X là C3H7NH2 có 4 CTCT thỏa mãn:
CH3CH2CH2NH2; CH3CH(NH2)CH3 ; CH3CH2NHCH3; CH3NH(CH3)C H3
→ Đáp án C
Câu 14:Cho m gam Anilin tác dụng hết với dung dịch Br2 thu được 9,9 gam kết tủa. Giá trị m đã dùng là
A. 0,93 gam
B. 2,79 gam
C. 1,86 gam
D. 3,72 gam
C6H5-NH2 + 3Br2 → C6H2Br3NH2 kết tủa + 3HBr.
⇒ n kết tủa = 0,03 mol.
⇒ nAnilin = n kết tủa = 0,03 mol.
⇒ m = 0,03.93 = 2,79g
→ Đáp án B
Câu 15: Tính thể tích nước brom 3% (D = 1,3 g/ml) cần dùng để điều chế 4,4 gam tribromanilin.
A. 164,1ml.
B. 49,23ml.
C. 88,61 ml.
D. số khác.
Đáp án
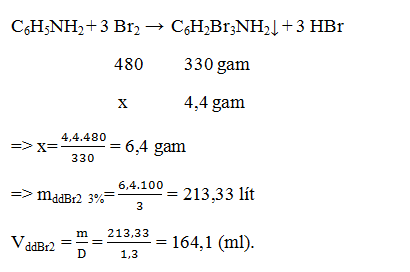
→ Đáp án A
Câu 16: Tính khối lượng anilin có trong dung dịch A. Biết khi cho A tác dụng với nước brom thì thu được 6,6 gam kết tủa trắng.
A. 2,79 gam
B. 1,86 gam
C. 3,72 gam
D. 0,93 gam
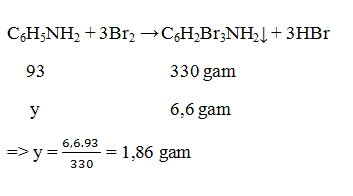
→ Đáp án B
Câu 17: Cho m gam etylamin tác dụng vừa đủ với 200 ml dung dịch H2SO4 1M thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là
A. 9,0.
B. 18,0.
C. 4,5.
D. 13,5.
Muối gồm (C2H5NH3)2SO4 (a mol) và C2H5NH3HSO4 (a mol)
nH2SO4 = a + a = 0,2 ⇒ a = 0,1
nC2H5NH2 = 2a + a = 0,3 ⇒ m = 45.0,3 = 13,5g
→ Đáp án D
Câu 18: Cho 13,95 gam anilin tác dụng với nước brom thu được m gam kết tủa trắng. Giá trị của m là:
A. 74,25 gam.
B. 49,5 gam.
C. 45,9 gam.
D. 24,75 gam.
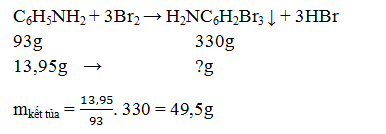
→ Đáp án B
Xem thêm các dạng bài tập Hoá học 12 hay, chi tiết khác:
70 Bài tập về Amin (2024) có đáp án chi tiết nhất
30 Bài tập về Cấu tạo và tính chất của amin, amino axit và protein (2024) có đáp án chi tiết nhất
1000 Bài tập hóa 12 Chương 3: Amin. amino axit và protein (có đáp án năm 2023)
70 Bài tập về Peptit và protein (2024) có đáp án chi tiết nhất