Bài tập về Amin
Kiến thức cần nhớ
Khái niệm, phân loại và danh pháp
1. Khái niệm
- Khi thay thế nguyên tử hiđro trong phân tử NH3 bằng gốc hiđrocacbon ta thu được amin.
- Ví dụ:
CH3–NH2; CH3–NH–CH3; CH3–; CH2=CH–CH2NH2; C6H5NH2
2. Phân loại
Amin được phân loại theo hai cách thông dụng nhất:
a) Theo gốc hiđrocacbon
– Amin mạch hở: CH3NH2, C2H5NH2, ...
– Amin thơm: C6H5NH2, CH3C6H4NH2, ...
– Amin dị vòng :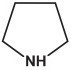 ;…
;…
b) Theo bậc amin
– Bậc amin thường được tính bằng số gốc hiđrocacbon liên kết với nguyên tử nitơ.
Theo đó, các amin được phân loại thành:
|
Amin bậc I |
Amin bậc II |
Amin bậc III |
|
R–NH2 |
R–NH–R’ |
|
|
R, R’ và R’’ là gốc hiđrocacbon |
||
- Ví dụ: amin bậc I: CH3CH2CH2NH2
amin bậc II: CH3CH2NHCH3
amin bậc III:
3. Đồng phân
Amin thường có đồng phân về:
– Mạch cacbon.
– Vị trí nhóm chức.
– Bậc của amin.
Ví dụ: Ứng với công thức phân tử C3H9N có các đồng phân:
CH3 – CH2 – CH2 – NH2
CH3 – CH (NH2) – CH3
CH3 – NH – CH2 – CH3
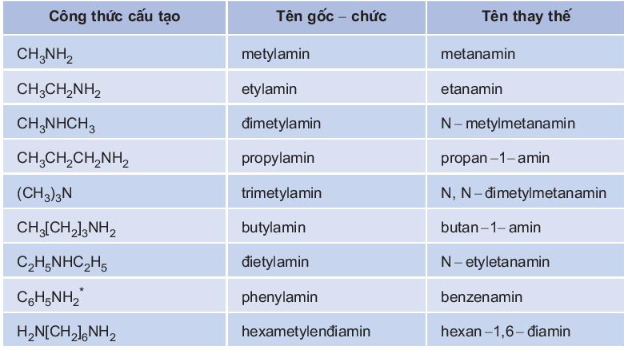
4. Danh pháp
Tên của các amin thường được gọi theo tên gốc – chức (gốc hiđrocacbon với chức amin) và tên thay thế.
a) Tên pháp gốc – chức = Tên gốc hiđrocacbon + amin
Ví dụ : CH3NH2 (Metylamin), C2H5–NH2 (Etylamin), CH3CH(NH2)CH3 (Isopropylamin), ….
b) Tên thay thế = Tên hiđrocacbon + vị trí + amin
Ví dụ : CH3NH2 (Metanamin), C2H5–NH2 (Etanamin), CH3CH(NH2)CH3 (Propan - 2 - amin), ...
Tên gọi của một số amin
Lưu ý:
– Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c, … + amin.
– Với các amin bậc 2 và 3, chọn mạch dài nhất chứa N làm mạch chính:
+ Có 2 nhóm ankyl → thêm 1 chữ N ở đầu.
Ví dụ : CH3–NH–C2H5 : N–metyletanamin.
+ Có 3 nhóm ankyl → thêm 2 chữ N ở đầu (nếu trong 3 nhóm thế có 2 nhóm giống nhau).
Ví dụ : CH3–N(CH3)–C2H5 : N, N–đimetyletanamin.
+ Có 3 nhóm ankyl khác nhau → 2 chữ N cách nhau 1 tên ankyl.
Ví dụ : CH3–N(C2H5 )–C3H7 : N–etyl–N–metylpropanamin.
– Khi nhóm –NH2 đóng vai trò nhóm thế thì gọi là nhóm amino.
Ví dụ : CH3CH(NH2)COOH (axit 2–aminopropanoic).
Tính chất vật lý
– Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí có mùi khai khó chịu, tan nhiều trong nước.
- Các amin có phân tử khối cao hơn là những chất lỏng hoặc rắn, nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Các amin thơm là chất lỏng hoặc rắn và dễ bị oxi hóa. Khi để trong không khí các amin thơm bị chuyển từ không màu thành màu đen vì bị oxi hóa.
- Các amin đều độc.

Cây thuốc lá chứa amin rất độc: nicotin
Cấu tạo phân tử và tính chất hóa học
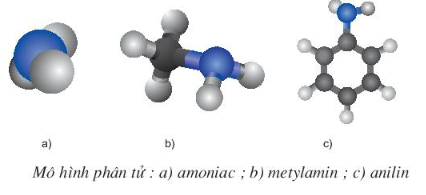
1. Cấu tạo phân tử
- Trong phân tử amin, nguyên tử nitơ còn một cặp electron tự do chưa liên kết có thể tạo liên kết cho – nhận giống NH3.
Vì vậy các amin có tính bazơ tương tự NH3.
- Ngoài ra, nguyên tử N trong amin có số oxi hóa -3 như trong NH3 nên amin thường dễ bị oxi hóa. Các amin thơm dễ tham gia phản ứng thế vào nhân thơm do ảnh hưởng của đôi electron chưa tham gia liên kết ở nguyên tử nitơ.
2. Tính chất hoá học
a) Tính bazơ
- Các amin tan nhiều trong nước như metylamin, etylamin … có khả năng làm xanh giấy quỳ tím hoặc hồng phenolphtalein, có lực bazơ mạnh hơn NH3 nhờ ảnh hưởng của nhóm ankyl.
- Anilin có tính bazơ, nhưng dung dịch của nó không làm xanh giấy quỳ tím cũng không làm hồng phenolphtalein vì lực bazơ của nó yếu và yếu hơn NH3. Đó là do ảnh hưởng của gốc phenyl (tương tự phenol).
- Ta có thể so sánh lực bazơ như sau:
CH3 – NH2 > NH3 > C6H5 – NH2
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
CH3NH2 + HCl → CH3NH3Cl
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa
Ví dụ :
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
Lưu ý : Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) hiđroxit kết tủa kết tủa tan (tạo phức chất).
b) Phản ứng thế ở nhân thơm của anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom: :
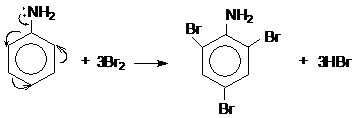
2, 4, 6 tribromanilin
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin
c) Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ:
C2H5NH2 + HONO ® C2H5OH + N2 ↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2 + HONO + HCl C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
d) Phản ứng cháy của amin no đơn chức mạch hở
Ví dụ:
V. Ứng dụng và điều chế
1. Ứng dung
Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm, polime (nhựa anilin - fomanđehit,…), dược phẩm …
2. Điều chế
- Thay thế nguyên tử H của phân tử amoniac
NH3 CH3NH2 (CH3)2NH (CH3)3N
- Khử hợp chất nitro
C6H5NO2 + 6H C6H5NH2 + 2H2O
Các dạng bài tập về Amin
Dạng 1: Lí thuyết trọng tâm
Dạng 2: Phản ứng với axit
Phương pháp giải
- Bản chất của phản ứng của amin tác dụng với dung dịch axit là:
-NH2 + H+ → -NH3+
(Phản ứng xảy ra tương tự với amin bậc 2, bậc 3)
- Các amin no có khả năng phản ứng được với dung dịch muối của một số kim loại tạo hidroxit kết tủa
Dạng 3: Phản ứng đốt cháy – Kết hợp giữa phản ứng cháy và phản ứng với axit
Phương pháp giải
Ta xét amin no, đơn chức mạch hở:
CnH2n+3N + O2 → n CO2 + H2O + ½ N2
Từ phương trình ta nhận thấy:
. và
Dạng 4: Phản ứng của anilin với brom
Dạng 5: Bài toán về phản ứng của amin với HNO2 và phản ứng thế ở vòng benzen
Phương pháp giải
Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ :
C2H5NH2+HONO→ C2H5OH + N2 + H2O
Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2+ HONO + HCl C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
Ví dụ minh hoạ
Ví dụ 1: Trong các chất dưới đây, chất nào có lực bazơ mạnh nhất?
A. NH3.
B. C6H5CH2NH2.
C. C6H5NH2.
D. (CH3)2NH.
Hướng dẫn giải:
C6H5NH2; C6H5CH2NH2 đều có chứa gốc hút e làm giảm tính bazơ
(CH3)2NH có chứa 2 gốc đẩy e làm tăng tính bazơ
Vậy nên (CH3)2NH là amin có lực bazơ mạnh nhất.
Đáp án cần chọn là: D
Ví dụ 2: Cho 6,2 gam metylamin (CH3NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
A. 7,65 gam.
B. 13,5 gam.
C. 8,10 gam.
D. 0,85 gam.
Hướng dẫn giải:
Amin đơn chức phản ứng với HCl theo tỉ lệ 1 : 1
Bảo toàn khối lượng:
Đáp án cần chọn là: B
Ví dụ 3: Hỗn hợp 1,07 gam hai amin đơn chức bậc nhất kế tiếp nhau trong dãy đồng đẳng phản ứng vừa hết với axit Nitrơ ở nhiệt độ thường tạo nên dung dịch X. Cho X phản ứng với Na dư thu được 0,03 mol H2. Công thức 2 amin là
Hướng dẫn giải chi tiết:
Đặt công thức trung bình của 2 amin là .
Sơ đồ phản ứng :
Theo sơ đồ ta thấy số mol 2 amin là 0,03 mol.
Vậy
Bài tập tự luyện
Câu 1: Phát biểu nào sau đây không đúng ?
A. Amin được cấu thành bằng cách thay thế H của NH3 bằng một hay nhiều gốc hiđrocacbon.
B. Bậc của amin là bậc của nguyên tử cacbon liên kết với nhóm amin.
C. Tùy thuộc cấu trúc của gốc hidrocacbon, có thể phân biệt thành amin no, chưa no và thơm.
D. Amin có từ 2 nguyên tử cacbon trong phân tử, bắt đầu xuất hiện hiện tượng đồng phân.
Hướng dẫn giải chi tiết:
Bậc của amin là số nguyên tử H trong phân tử NH3 bị thế bởi nhóm hidro cacbon
=> B sai
Đáp án B
Câu 2: Số đồng phân amin bậc một ứng với công thức phân tử C4H11N là :
A. 2.
B. 5.
C. 3.
D. 4.
Hướng dẫn giải chi tiết:
Đối với amin, có 2 loại đồng phân là đồng phân mạch C và đồng phân vị trí nhóm chức.
Các đồng phân amin bậc 1 ứng với công thức phân tử C4H11N là:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
CH3-C(CH3)(NH2)-CH3 (4)
Đáp án D.
Câu 3: Nguyên nhân amin có tính bazơ là :
A. Có khả năng nhường proton.
B. Trên N còn một đôi electron tự do có khả năng nhận H+.
C. Xuất phát từ amoniac.
D. Phản ứng được với dung dịch axit.
Hướng dẫn giải chi tiết:
Nguyên nhân amin có tính axit là do trên N còn 1 đôi electron tự do có khả năng nhận H+
Đáp án B
Câu 4: Hãy sắp xếp các chất sau đây theo trật tự tăng dần tính bazơ : (1) amoniac ; (2) anilin ;
(3) etylamin ; (4) đietylamin ; (5) kalihiđroxit.
A. (2) < (1) < (3) < (4) < (5).
B. (1) < (5) < (2) < (3) < (4).
C. (1) < (2) < (4) < (3) < (5).
D. (2) < (5) < (4) < (3) < (1).
Hướng dẫn giải chi tiết:
Để xét tính bazo của aminno axit, phụ thuộc vào gốc hidrocacbon liên kết với nhóm amino.
Gốc hidro cacbon đẩy e => Làm tăng tính bazo của amin hơn so với NH3
Gốc hidrocacbon hút e => Làm giảm tính bazo của amin hơn so với NH3
Anilin có chứa nhóm hút e
=> Tính bazo của anilin nhỏ hơn so với NH3 (I)
(4) có nhiều gốc đẩy e hơn so với (3)
=> dietyl amin > etylamin > amoniac (II)
=> Ta có được thứ tự là: (2) < (1) < (3) < (4) < (5)
Đáp án A
Câu 5: Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 15 gam muối. Số đồng phân cấu tạo của X là :
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải chi tiết
Áp dụng định luật bảo toàn khối lượng ta có:
m HCl phản ứng = m muối – m X
=> m HCl = 15 – 10 = 5 gam
=> n HCl = 5/36,5 (mol)
Ta có : n X = n HCl = 5/36,5 (X là amin đơn chức nên sẽ phản ứng với HCl theo tỉ lệ 1:1)
=> M X = 10 : 5 /36,5 = 73 (gam/mol)
=> X là : C4H11N
Các đồng phân của X là:
* Amin bậc 1:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
(CH3)2-C(NH2)-CH3 (4)
* Amin bậc 2:
CH3-NH-CH2-CH2-CH3 (5)
CH3-NH-CH(CH3)-CH3 (6)
CH3-CH2-NH-CH2-CH3 (7)
* Amin bậc 3:
(CH3)2N-CH2-CH3 (8)
Đáp án B.
Câu 6: Hỗn hợp X gồm metylamin, etylamin và propylamin có tổng khối lượng 21,6 gam là và tỉ lệ về số mol là 1 : 2 : 1. Cho hỗn hợp X trên tác dụng hết với dung dịch HCl thu được dung dịch chứa bao nhiêu gam muối ?
A. 36,2 gam.
B. 39,12 gam.
C. 43,5 gam.
D. 40,58 gam.
Hướng dẫn giải chi tiết:
Gọi số mol của CH3NH2, C2H5NH2, C3H7NH2 lần lượt là x, 2x, x (mol)
Khối lượng của 3 amin là 21,6 gam
=> 31x + 45.2x + 59x = 21,6 => x = 0,12
Tổng số mol của 3 amin là : 0,12 + 0,12 .2 + 0,12 = 0,48 (mol)
=> n HCl = n Amin = 0,48 mol
Áp dụng định luật bảo toàn khối lượng ta có:
m Amin + m HCl = m Muối
=> m Muối = 21,6 + 0,48 . 36,5 = 39,12 gam
Đáp án B
Câu 7: Cho 21,9 gam amin đơn chức X phản ứng hoàn toàn với dung dịch FeCl3 (dư), thu được 10,7 gam kết tủa. Số đồng phân cấu tạo bậc 1 của X là :
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải chi tiết
Ta có phương trình phản ứng:
3RNH2 + Fe3+ + H2O → 3[RNH3]+ + Fe(OH)3 (1)
n Fe(OH)3 = 10,7 : 107 = 0,1 (mol)
n Amin = 3 n Fe(OH)3 = 0,3 mol
=>Khối lượng mol của amin là: 21,9 : 0,3 = 73 gam/mol
=> X là : C4H9NH2
=> Số đồng phân cấu tạo bậc 1 của X là:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
CH3-C(CH3)(NH2)-CH3 (4)
Đáp án D.
Câu 8: Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của2 amin là :
A. CH5N và C2H7N.
B. C2H7N và C3H9N.
C. C3H9N và C4H11N.
D. kết quả khác.
Hướng dẫn giải chi tiết:
n H2O = 3,6 : 18 = 0,2 (mol)
n CO2 = 2,24 : 22,4 = 0,1 (mol)
=> Số mol của hỗn hợp amin là : (0,2 – 0,1) : 1,5 = 0,2/3 (mol)
Số nguyên tử C trung bình có trong hỗn hợp amin là:
n CO2 : n Amin = 0,1 : 0,2/3 = 1,5
2 amin thuộc dãy đồng đẳng liên tiếp
=> Công thức của 2 amin là CH5N và C2H7N
Đáp án A.
Câu 9: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. CTPT của X là :
A. C4H9N.
B. C3H7N.
C. C2H7N.
D. C3H9N
Hướng dẫn giải chi tiết:
n N2 = 2,8 : 22,4 = 0,125 (mol)
n Amin = n N (có trong amin) = 0,125 . 2 = 0,25 (mol)
n CO2 = 16, 8 : 22,4 = 0,75 (mol)
=> Số nguyên tử C có trong amin là: 0,75 : 0,25 = 3
n H2O = 20,25 : 18 = 1,125 (mol)
=> Số nguyên tử H có trong amin là: 1,125 . 2 : 0,25 = 9
=> CTPT của amin là: C3H9N
Đáp án D.
Câu 10: 0,1 mol etylamin tác dụng hết với dung dịch HNO2 dư thu được V lít khí N2. Giá trị của V là
Hướng dẫn giải chi tiết:
C2H5NH2 + HNO2 → C2H5OH + N2 + H2O
0,1 mol → 0,1 mol
=> V = 0,1.22,4 = 2,24 lít
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
Tính chất hóa học của rượu Etylic (ancol etylic hoặc etanol) chi tiết nhất (2024)
90 Bài tập Đồng và hợp chất của đồng (có đáp án)
70 Bài tập về Crom và hợp chất của Crom (2024) có đáp án chi tiết nhất
70 Bài tập sắt và hợp chất của sắt (2024) có đáp án (chi tiết nhất)
70 Bài tập về Peptit và protein (2024) có đáp án chi tiết nhất












