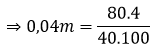Bài tập về Amino axit
Kiến thức cần nhớ
Khái niệm
- Amino axit là loại hợp chất hữu cơ tạp chức mà phân tử chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH).
Công thức chung: (H2N)x – R – (COOH)y
Danh pháp
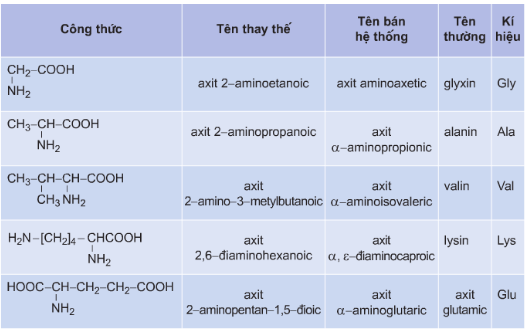
a) Tên thay thế: axit + vị trí nhóm NH2 + amino + tên axit cacboxylic tương ứng.
Ví dụ: H2N–CH2–COOH: axit aminoetanoic
HOOC–[CH2]2–CH(NH2)–COOH: axit 2-aminopentanđioic
b) Tên bán hệ thống: axit + vị trí chữ cái Hi Lạp (α, β, γ, δ, ε, ω) của nhóm NH2 + amino + tên thông thường của axit cacboxylic tương ứng.
Ví dụ: CH3–CH(NH2)–COOH : axit α-aminopropionic
H2N–[CH2]5–COOH : axit ε-aminocaproic
H2N –[ CH2]6–COOH: axit ω-aminoenantoic
c) Tên thông thường: các amino axit thiên nhiên (α-amino axit) đều có tên thường.
Ví dụ: H2N –CH2–COOH có tên thường là glyxin (Gly) hay glicocol
Tên gọi của một số α - amino axit
Tính chất vật lý
Các amino axit là các chất rắn không màu, vị hơi ngọt, dễ tan trong nước vì chúng tồn tại ở dạng ion lưỡng cực (muối nội phân tử), nhiệt độ nóng chảy cao (vì là hợp chất ion).
H2N – CH2 – COOH ⇄
Dạng phân tử Dạng ion lưỡng cực
Tính chất hóa học
1. Tính chất lưỡng tính
- Tác dụng với dung dịch bazơ (do có nhóm COOH)
H2N – CH2–COOH + NaOH → H2N – CH2–COONa + H2O
- Tác dụng với dung dịch axit (do có nhóm NH2)
H2N – CH2–COOH + HCl → ClH3N– CH2–COOH
2. Tính axit – bazơ của dung dịch aminoaxit
Xét amino axit tổng quát: (H2N)x – R – (COOH)y. Khi:
- x = y thì amino axit trung tính, quỳ tím không đổi màu
- x > y thì amino axit có tính bazơ, quỳ tím hóa xanh
- x < y thì amino axit có tính axit, quỳ tím hóa đỏ
3. Phản ứng riêng của nhóm COOH: Phản ứng este hóa
Tương tự với axit cacboxylic, amino axit phản ứng với ancol khi có mặt axit vô cơ mạnh sinh ra este. Ví dụ:
H2NCH2COOH + C2H5OH H2NCH2COOC2H5 + H2O
4. Phản ứng trùng ngưng
- Khi đun nóng, các ε – hoặc ω – amino axit tham gia phản ứng trùng ngưng tạo thành polime thuộc loại poliamit.
- Trong phản ứng này, -OH của nhóm COOH ở phân tử amino axit này kết hợp với H của nhóm NH2 ở phân tử amino axit kia thành nước và sinh ra polime do các gốc amino axit kết hợp với nhau. Ví dụ:
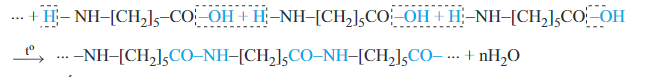
Hay có thể viết gọn là:
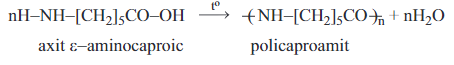
5. Phản ứng đặc trưng của nhóm NH2: phản ứng với HNO2
Ví dụ:
H2N – CH2–COOH + HNO2 → HO– CH2 –COOH + N2↑ + H2O
Ứng dụng
- Amino axit thiên nhiên (hầu hết là α-amino axit) là cơ sở để kiến tạo nên các loại protein của cơ thể sống
- Muối mononatri của axit glutamic được dùng làm mì chính (hay bột ngọt)
- Axit ε-aminocaproic và axit ω-aminoenantoic là nguyên liệu sản xuất tơ tổng hợp (nilon – 6 và nilon – 7)
- Axit glutamic là thuốc hỗ trợ thần kinh, methionin là thuốc bổ gan…
Các dạng bài tập về Amino axit
Dạng 1: Lí thuyết trọng tâm
Dạng 2: Tính lưỡng tính của amino axit
Bài toán 1: Amino axit tác dụng với axit
Bài toán 2: Amino axit tác dụng với bazơ
Bài toán 3: Amino axit tác dụng với axit hoặc amino axit tác dụng với bazơ
Dạng 3: Phản ứng nối tiếp
Bài toán 1: Amino axit tác dụng với axit tạo dung dịch X. Cho X tác dụng tiếp với dung dịch bazơ
Bài toán 2: Amino axit tác dụng với dung dịch bazơ tạo dung dịch X. Cho X tác dụng tiếp với axit
Dạng 4: Phản ứng cháy của amino axit
Bài toán 1: Xác định lượng chất trong phản ứng
Bài toán 2: Xác định công thức của amino axit
Bài tập tự luyện
1. Bài tập vận dụng
Câu 1: Amino axit là hợp chất hữu cơ trong phân tử
A. chứa nhóm cacboxyl và nhóm amino.
B. chỉ chứa nhóm amino.
C. chỉ chứa nhóm cacboxyl.
D. chỉ chứa nitơ hoặc cacbon.
Hướng dẫn giải chi tiết:
Amino axit là hợp chất hữu cơ trong phân tử chứa nhóm cacboxyl và nhóm amino.
Đáp án A.
Câu 2: : Ở điều kiện thường, các amino axit
A. đều là chất khí.
B. đều là chất lỏng.
C. đều là chất rắn.
D. có thể là rắn, lỏng hoặc khí.
Hướng dẫn giải chi tiết:
Amino axit là hợp chất tồn tại ở dạng lưỡng cực : NH3+-R-COO-
=> Ở điều kiện thường, các amino axit đều là chất rắn.
Đáp án C.
Câu 3: pH của dung dịch cùng nồng độ mol của 3 chất H2NCH2COOH, CH3CH2COOH và CH3(CH2)3NH2 tăng theo trật tự nào sau đây ?
A. CH3(CH2)3NH2 < H2NCH2COOH < CH3CH2COOH.
B. CH3CH2COOH < H2NCH2COOH < CH3(CH2)3NH2.
C. H2NCH2COOH < CH3CH2COOH < CH3(CH2)3NH2.
D. H2NCH2COOH < CH3(CH2)3NH2 < CH3CH2COOH.
Hướng dẫn giải chi tiết:
CH3CH2COOH có môi trường axit
NH2CH2COOH có môi trường trung tính
CH3(CH2)3NH2 có môi trường bazo
=> Vậy pH của 3 chất trên được sắp sếp như sau:
CH3CH2COOH < H2NCH2COOH < CH3(CH2)3NH2.
Đáp án B.
Câu 4: : Cho các dãy chuyển hóa : Glyxin X1 X2. Vậy X2 là :
A. H2NCH2COOH.
B. H2NCH2COONa.
C. ClH3NCH2COOH.
D. ClH3NCH2COONa
Hướng dẫn giải chi tiết:
Ta có phương trình phản ứng:
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
H2NCH2COONa + 2HCl → ClH3NCH2COOH + NaCl
Đáp án C
Câu 5: Cho hỗn hợp 2 aminoaxit no chứa 1 chức axit và 1 chức amino tác dụng với 110 ml dung dịch HCl 2M được dung dịch X. Để tác dụng hết với các chất trong X, cần dùng 140 ml dung dịch KOH 3M. Tổng số mol 2 aminoaxit là :
A. 0,1.
B. 0,2.
C. 0,3.
D. 0.4.
Hướng dẫn giải chi tiết:
2 amin trên có dạng NH2-R-COOH
Ta có sơ đồ quá trình phản ứng như sau:
n HCl = 0,1 * 2 = 0,22 mol
n KOH = 0,14 * 3 = 0,42 mol
Áp dụng định luật bảo toàn nguyên tố Clo
=> n HCl = nKCl = 0,22 (mol)
Áp dụng định luật bảo toàn nguyên tố K
=> n KOH = n KCl + n NH2-R-COOK
=> n NH2-R-COOK = 0,42 – 0,22 = 0,2 (mol)
=> n Amino axit = n NH2-R-COOK = 0,2 (mol)
Đáp án B.
Câu 6: Hợp chất X là một a-amino axit. Cho 0,01 mol X tác dụng vừa đủ với 80 ml dung dịch HCl 0,125M, sau đó đem cô cạn dung dịch thu được 1,835 gam muối. Phân tử khối của X là :
A. 174.
B. 147.
C. 197.
D. 187.
Hướng dẫn giải chi tiết:
n HCl = 0,08 * 0,125 = 0,01 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
m X + m HCl = m Muối
=> m X = 1,835 – 0,01 * 36,5 = 1,47 (gam)
Khối lượng mol của X là:
1,47 : 0,01 = 147 (gam/mol)
Đáp án B.
Câu 7: Khi đốt cháy hoàn toàn một amino axit X là đồng đẳng của axit aminoaxetic, thu được . Công thức cấu tạo thu gọn có thể có của X là :
A. CH3CH(NH2)COOH, H2NCH2CH2COOH.
B. H2N[CH2]3COOH, CH3CH(NH2)CH2COOH.
C. H2N[CH2]4COOH, H2NCH(NH2)[CH2]2COOH.
D. Kết quả khác.
Hướng dẫn giải chi tiết:
X là đồng đẳng của axit amino axetic
=> X là amino axit no, đơn chức mạch hở
CTPT của X có dạng: CnH2n+1NO2
Ta có phương trình đốt cháy:
CnH2n+1NO2 + O2 → n CO2 + (2n+1)/2 H2O + N2
Vì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol
=> V CO2 / V H2O = n : = 6 : 7
=> n = 3
=> CTPT của X là: C3H7NO2
CTCT của X có thể có là: CH3CH(NH2)COOH, H2NCH2CH2COOH.
Đáp án A
Câu 8: Đốt cháy 8,7 gam amino axit X thì thu được 0,3 mol CO2 ; 0,25 mol H2O và 0,05 mol N2 (đktc). CTPT của X là :
A. C3H7O2N.
B. C3H5O2N.
C. C3H7O2N2
D. C3H9O2N2.
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn nguyên tố ta có:
n C = n CO2 = 0,3 mol
n H = 2 n H2O = 0,25 .2 = 0,5 mol
n N = 2 n N2 = 0,05 .2 = 0,1 mol
m O = m X – m C – m H – m O
= 8,7 – 0,3 .12 – 0,5 . 1 – 0,1 . 14 = 3,2 gam
=> n O = 3,2 : 16 = 0,2 mol
Ta có: n C : n H : n N : n O
= 0,3 : 0,5 : 0,1 : 0,2 = 3 : 5 : 1 : 2
=> CTPT của X là : C3H5NO2
Đáp án B
2. Bài tập tự luyện có hướng dẫn
Bài 1: Cho 0,1 mol H2NC3H5(COOH)2 (axit glutamic) vào 125 ml dung dịch HCl 2M, thu được dung dịch X. Cho một lượng vừa đủ dung dịch NaOH vào X để phản ứng xảy ra hoàn toàn số mol NaOH đã phản ứng là
A.0,45. B.0,60. C.0,35. D. 0,50.
Đáp án: A
nNaOH = nH+ = nOH+ = 0,1.2 + 0,125.2 = 0,45 mol
Bài 2: Cho 7,35 gam axit glutamic phản ứng với 140 ml dung dịch HCl 1M, thu được dung dịch X. Cho 250 ml dung dịch NaOH 1M vào X, thu được dung dịch Y. Cô cạn dung dịch Y, thu được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn, giá trị của m là
A. 16,64. B. 19,04. C. 17,74. D. 18,14.
Đáp án: D
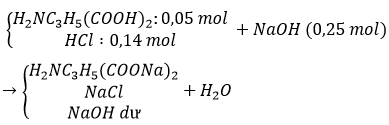
nH2O = nH+= 0,05.2 + 0,14 = 0,24 mol
bảo toàm khối lượng ⇒ m= 7,35 + 0,14.36,5 +0,25.40 – 0,24.18 = 18.14 gam
Bài 3: Cho 0,04 mol amino axit X tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được 7,34 gam muối khan. Mặt khác 0,04 mol X tác dụng vừa đủ với 80 gam durig dịch NaOH 4%. Công thức của X là
A. H2NC3H6COOH. B. H2NC2H3(COOH)2.
C (H2N)2C3H5COOH. D. H2NC3H5(COOH)2.
Đáp án: D
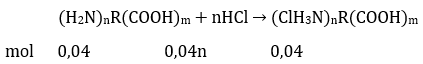
0,04n = 0,1.0,4 ⇒ n = 1 ;
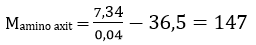
nH+ = nOH-
⇒m = 2 ⇒ R + 16 + 45.2 = 147
⇒ R = 41 (C3H5) ⇒X: H2NC3H5(COOH)2
Bài 4: Amino axit X có công thức H2NCxHy(COOH)2. Cho 0,1 mol X vào 0,2 lít dung dịch H2SO4 0,5M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với dung dịch gồm NaOH 1M và KOH 3M, thu được dung dịch chứa 36,7 gam muối. Phần trăm khối lượng của nitơ trong X là
A. 9,524%. B. 10,687%.
C. 10,526%. D. 11,966%.
Đáp án: C
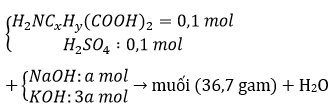
nH2O = nH+=nOH- = 0,1.2+0,1.2=0,4 mol ⇒a+3a=0,4 ⇒a=0,1
Bảo toàn khối lượng: mX + mH2SO4 + mNaOH + mKOH = mMuối + mH2O
⇒ mX + 0,1. 98 + 0,1. 40 + 0,3. 56 = 36,7 + 0,4. 18
⇒ mX = 13,3 gam
Có: mN = 0,1. 14 = 1,4g
⇒ %mN = 10,526%
Bài 5: Hỗn hợp X gồm glyxin, alanin và axit glutamic. Trong X, nguyên tố oxi chiếm 40% về khối lượng. Cho m gam X tác dụng hoàn toàn với dung dịch NaOH, tạo ra 8,16 gam muối. Giá trị của m là
A. 7,2. B. 4.8. C. 5.6. D. 6,4
Đáp án: D
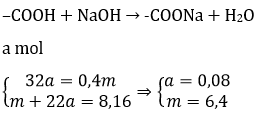
Bài 6: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu hồng ?
A. axit a-aminopropionic B. axit a,e-điaminocaproic
C. axit a-aminoglutaric D. axit aminoaxetic
Đáp án: C
Bài 7: Phát biểu nào sau đây là đúng ?
A. Ở nhiệt độ thường, các amino axit đều là chất lỏng.
B. Axit glutamic là thành phần chính của bột ngọt,
C. Amino axit thuộc loại họp chất hữu cơ tạp chức.
D. Các amino axit thiên nhiên hầu hết là các p-amino axit.
Đáp án: C
– Ở nhiệt độ thường, các amino axit đều là chất rắn
- Thành phần chính của bột ngọt là muối mononatri của axit glutamic
- Các amino axit thiển nhiên hầu hết là các α- amino axit
Bài 8: Cho m gam H2NCH2COOH phản ứng hết với dung dịch KOH, thu được dung dịch chứa 16,95 gam muối. Giá trị của m là
A. 16,95. B. 11,25. C, 13,05. D. 22,50.
Đáp án: B
H2NCH2COOH + KOH → H2NCH2COOK +H2O
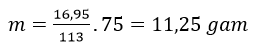
Bài 9: Amino axit X chứa một nhóm -NH2. Cho 15 gam X tác dụng với axit HCl (dư), thu được 22,3 gam muối khan. Công thức cấu tạo thu gọn của X là
A. H2NCH2COOH. B. CH3CH2CH(NH2)COOH.
C. H2NCH2CH2COOH. D. CH3CH(NH2)COOH.
Đáp án: A
H2N-R-(COOH)X + HCl → ClH3N-R-(COOH)X
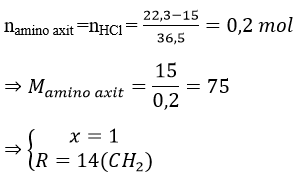
⇒ X: H2NCH2COOH
Bài 10: Trong phân tử amino axit X có một nhóm amino và một nhóm cacboxyl. Cho 8,9 gam X tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được 11,1 gam muối khan. Công thức của X là
A. H2NC2H4COOH. B. H2NCH2COOH.
C. H2NC3H6COOH. D. H2NC4H8COOH.
Đáp án: A
H2N-R-COOH + NaOH → H2N-R-COONa +H2O
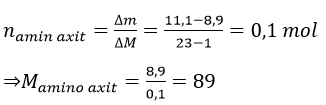
⇒ R + 61 = 89
⇒ R = 28 (C2H4) ⇒ X: H2NC2H4COOH
A. cacboxyl và hiđroxyl. B. hiđroxyl và amino,
C. cacboxyl và amino. D. cacbonyl và amino.
Đáp án: C
Bài 12: Công thức của glyxin là
A. CH3NH2. B. H2NCH(CH3)COOH,
C. H2NCH2COOH. D. C2H5NH2.
Đáp án: C
Bài 13: Số nhóm amino và số nhóm cacboxyl có trong một phân tử axit glutamic tương ứng là
A. 2 và 2. B. l và 2. C 2 và l. D. 1 và 1.
Đáp án: B
Bài 14: Số đồng phân cấu tạo của amino axit ứng với công thức phân tử C3H7O2N là
A.2. B. 4. C. 3. D. 1.
Đáp án: A
Bài 15: Số đồng phân cấu tạo của amino axit ứng với công thức phân tử C4H9NO2 là
A. 3. B.4.
C. 5. D. 6.
Đáp án: C
H2NCH2CH2CH2COOH; CH3CH(NH2)CH2COOH; CH3CH2CH(NH2)COOH; H2NCH(NH3)CH2COOH; (CH3)2C(NH2)COOH
Bài 16: Dung dịch nào sau đây làm quỳ tím đổi thành màu xanh ?
A. dung dịch alanin B. dung dịch glyxin
C. dung dịch lysin D. dung dịch valin
Đáp án: C
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
Tính chất hóa học của rượu Etylic (ancol etylic hoặc etanol) chi tiết nhất (2024)