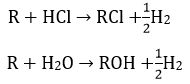Lý thuyết, phương pháp điều chế kim loại
1. Lý thuyết
1.1 Khái niệm
Kim loại là tập hợp các nguyên tố có khả năng tạo ra các ion dương và có liên kết kim loại. Giống với á kim và các phi kim, kim loại là một trong những nguyên tố được phân biệt bởi độ ion hóa.
Trong bảng tuần hoàn nguyên tố hóa học, đường chéo vẽ từ Bo tới Poloni chia tách các kim loại với các phi kim, ở bên trái đường chia cắt là kim loại còn ở góc trên bên phải đường này là các phi kim.
1.2 Tính chất vật lí
Kim loại có tính cứng, màu sắc ánh kim, có thể dát mỏng và gia công thành nhiều hình thù đa dạng. Nhờ các ion, chúng dẫn điện tốt. Ngoài ra, kim loại còn có từ tính và dẫn nhiệt tốt, có điểm nóng chảy cao. Tính giãn nở nhiệt cũng là đặc trưng của kim loại, khi gặp nhiệt độ nóng chúng có xu hướng giãn ra; Ngược lại, khi gặp nhiệt độ thấp (lạnh), chúng sẽ co lại. Hay Hầu hết, ở nhiệt độ môi trường, kim loại ở thể rắn, trừ thủy ngân và copernixi (ở thể lỏng).
Về cơ tính, kim loại và các hợp kim của nó có tính dẻo, đàn hồi, và có độ bền kéo, độ bền nén nhất định. Tùy vào cấu tạo mà mỗi kim loại có mức độ cơ tính, lý tính cao hơn hay thấp hơn nhau.
Ngoài ra, kim loại là vật liệu có nhiều ưu điểm nhất trong gia công như đúc, rèn, cắt gọt, đột, dập, chấn, hàn mài… Đặc biệt, với công nghệ nhiệt luyện, độ cứng của kim loại và hợp kim có thể được thay đổi. Nhằm tạo ra nhiều loại vật liệu khác nhau.
1.3 Tính chất Hóa Học
Kim loại có thể tác dụng với phi kim, axit, nước, muối để tạo thành các hợp chất. Phản ứng hóa học của kim loại với các chất này có thể có hoặc không có chất xúc tác đi kèm.
Tác dụng với axit
Khi kim loại phản ứng với axit sẽ tạo ra muối và khí Hidro. Trong trường hợp chất phản ứng là axit đặc, nóng, phản ứng tạo ra muối Nitrat và các khí (như N2, NO2, NO…). Hay muối Sunfat và các khí (SO2, H2S).
Tác dụng với phi kim
Phi kim là những nguyên tố nằm bên phải bảng tuần hoàn hóa học. Có tính chất không dẫn điện (ngoại trừ Cacbon, graphit), dễ nhận electron (ngoại trừ Hidro). Một số phi kim: oxi, nitơ, photpho, lưu huỳnh, cacbon, hiđrô…
Khi kim loại tác dụng với phi kim sẽ tạo ra oxit (khi phản ứng với O2). Hoặc tạo ra muối khi phản ứng với các phi kim khác như Cl, S…
Tác dụng với nước
Ở nhiệt độ thường và nhiệt độ cao, khi kim loại tác dụng với nước có thể cho ra bazơ, kim loại kiềm hay oxit và hidro.
Tác dụng với muối
Khi kim loại được kết hợp với một muối của kim loại yếu hơn nó, phản ứng sẽ tạo ra muối và kim loại mới.
1.4 Phương pháp điều chế
Phương pháp thủy luyện
– Nguyên tắc: Dùng dung dịch thích hợp (HCl, HNO3 , nước cường toan, CN– …) hòa tan nguyên liệu sau đó lấy kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi dung dịch của nó.
– Phạm vi sử dụng: thường dùng trong phòng thí nghiệm để điều chế các kim loại sau Mg (thường là kim loại yếu).
Phương pháp nhiệt luyện
– Nguyên tắc: dùng chất khử CO, C, Al, H2 khử oxit kim loại ở nhiệt độ cao.
– Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al.
Các phản ứng dùng kim loại kiềm và kim loại kiềm thổ làm chất khử đều phải thực hiện trong môi trường khí trơ hoặc chân không
– Trường hợp quặng là sunfua kim loại như Cu2S, ZnS, FeS2 …thì phải chuyển sunfua kim loại thành oxit kim loại. Sau đó khử oxit kim loại bằng chất khử thích hợp.
– Đối với kim loại khó nóng chảy như Cr, người ta dùng Al làm chất khử (phản ứng nhiệt nhôm). Phản ứng nhiệt nhôm tỏa nhiệt mạnh, lượng nhiệt tạo ra được sử dụng để đun nóng chảy Cr2O3 , nhờ vậy giảm được chi phí cho nhiên liệu:
Cr2O3 + 2Al → 2Cr + Al2O3
– Đối với những kim loại kém hoạt động như Hg, Ag chỉ cần đốt cháy quặng cũng thu được kim loại mà không cần dùng chất khử
HgS + O2 → Hg + SO2
Phương pháp điện phân
Điện phân nóng chảy
– Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
– Phạm vi sử dụng: có thể dùng để điều chế tất cả các kim loại nhưng thường dùng với kim loại mạnh: K, Na, Mg, Ca, Ba và Al.
Điện phân dung dịch
– Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
– Phạm vi sử dụng: Dùng điều chế các kim loại yếu
2. Bài tập vận dụng
Câu 1: Phát biểu nào sau đây là sai ?
A. Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần.
B. Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng,
C. Kim loại có độ âm điện bé hơn phi kim trong cùng chu kì.
D. Đa số các kim loại đều có cấu tạo tinh thể.
Lời giải: A. Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần.
Câu 2: Nguyên tố X ở ô số 24 của bảng tuần hoàn. Một học sinh đã đưa ra các nhận xét về nguyên tố X như sau :
(1) X có 6 e hoá trị yà là nguyên tố kim loại.
(2) X là một nguyên tố nhóm d.
(3) X nằm ở chu kì 4 của bảng tuần hoàn.
(4) Ở trạng thái cơ bản, X có 6 e ở phân lớp s;
Trong các nhận xét trên, số nhận xét đúng là
A. 1. B. 2. C. 3. D. 4.
Lời giải: C. 3
Cấu hình e của nguyên tố này là: 1s22s22p63s23p63d54s1
Các phát biểu 1,2,3 đúng
Câu 3: Cấu hình electron nguyên tử của ba nguyên tố X, Y, Z lần lượt là ls22s22p63s2, ls22s22p63s23p64s1, ls22s22p63s1. Nếu xếp theo chiều tăng dần tính kim loại thì cách sắp xếp nào sau đây đúng ?
A. Y < Z < X. B. X < Z < Y.
C. X ≤ Y ≤ Z. D. Z < X < Y.
Lời giải: B. X < Z < Y.
X và Z cùng chu kì, ZX > ZZ nên tính kim loại của X < Z
Y và Z cùng nhóm IA; ZY > ZZ nên tính kim loại của Y > Z
Suy ra tính kim loại: X < Z < Y
Câu 4: Kết luận nào sau đây sai?
A. Các nguyên tố nhóm A có cấu hình e lớp ngoài cùng ns2 đều là các kim loại.
B. Nguyên tố có Z = 19 có bán kính lớn hơn nguyên tố có Z = 11
C. Li là kim loại có độ âm điện lớn nhất trong số các kim loại kiềm
D. Các nguyên tố nhóm B đều là kim loại
Lời giải: A. Các nguyên tố nhóm A có cấu hình e lớp ngoài cùng ns2 đều là các kim loại.
he có cấu hình e lớp ngoài cùng là 1s2 và là khí hiếm
Câu 5: R là một kim loại thuộc nhóm IA của bảng tuần hoàn. Lấy 17,55 gam R tác dụng với 25 gam dung dịch HCl 29,2%. Sau khi phản ứng xảy ra hoàn toàn cho bốc hơi cẩn thận dung dịch tạo thành trong điều kiện không có không khí thì thu được 28,9 gam hỗn hợp rắn gồm hai chất. Kim loại R là:
A. Na B. K C. Rb D. Cs
Lời giải: B. K
a có nHCl = 0,2 mol
Xét các phản ứng:
Trong 28,9 gam chất rắn bao gồm ROH và RCl ⇒ 28,9 = mR+ + mCl- + mOH-
nCl- = nHCl = 0,2 mol; mR = 17,55 gam
nOH- = 0,25 mol
nR = 0,45 mol và MR = 39 ⇒ R là kim loại K
Xem thêm các bài tập Hóa Học hay khác:
Cách điều chế nhựa PE (2024) chính xác nhất
Phương pháp điều chế CO2 trong phòng thí nghiệm (2024) chính xác nhất
Phương pháp điều chế HNO3 (2024) chính xác nhất