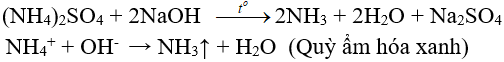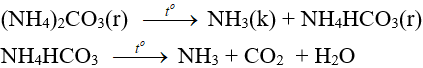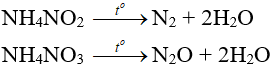Phản ứng NH4NO3+ Ba(OH)2→ Ba(NO3)2+ NH3+ H2O
1. Phương trình phản ứng NH4NO3 tác dụng Ba(OH)2
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
2. Phương trình ion rút gọn NH4NO3 tác dụng Ba(OH)2
NH4+ + OH− → NH3 + H2O
3. Điều kiện NH4NO3 tác dụng Ba(OH)2
Cho NH4NO3 tác dụng với dung dịch Ba(OH)2, điều kiện: Nhiệt độ
4. Cách thực hiện phản ứng
Đun nóng dung dịch chứa hỗn hợp NH4NO3 và Ba(OH)2
5. Hiện tượng phản ứng khi cho NH4NO3 tác dụng Ba(OH)2
Khi cho NH4NO3 tác dụng với dung dịch Ba(OH)2, xuất hiện bọt khí có mùi khai do khí Amoniac (NH3) sinh ra.
6. Bản chất của các chất tham gia phản ứng
6.1. Bản chất của NH4NO3 (Amoni nitrat)
NH4NO3có thể tác dụng với các bazơ như KOH, NaOH,Ba(OH)2,...
6.2. Bản chất của Ba(OH)2 (Bari hidroxit)
Ba(OH)2là một bazơ mạnh tác dụng được vớiNH4NO3.
7. Mở rộng tính chất hoá học của muối amoni
7.1. Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
7.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
7.3. Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
8. Mở rộng tính chất hóa học của Ba(OH)2
Mang đầy đủ tính chất hóa học của một bazơ mạnh.
Phản ứng với các axit:
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Phản ứng với oxit axit:SO2, CO2...
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Phản ứng với các axit hữu cơ tạo thành muối:
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
Phản ứng thủy phân este:
2CH3COOC2H5 + Ba(OH)2 → (CH3COO)2Ba + 2 C2H5OH
Phản ứng với muối:
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Tác dụng một số kim loại mà oxit, hidroxit của chúng có tính lưỡng tính(Al, Zn...):
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2↑
Tác dụng với hợp chất lưỡng tính:
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2
9. Bài tập vận dụng liên quan (có đáp án)
Câu 1. Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
A. 2,24 lít
B. 4,48 lít
C. 22,4 lít
D. 44,8 lít
Lời giải:
Đáp án B
PTHH: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
Tỉ lê: 1 2
Pứ: 0,1 ? mol
Từ PTHH ta có n NH3 = 2 n Ba(OH)2 = 0,2 mol
=> V NH3 = n NH3 . 22,4 = 0,2 . 22,4 = 44,8 lít
Câu 2.Cho dung dịch NH4NO3 tác dụng với dung dịch Ba(OH)2 dư, sau khi đun nóng nhẹ thu được 4,48 lít khí (đktc) và m gam muối. Giá trị của m là
A. 33,1
B. 39,8
C. 16,0
D. 26,1
Lời giải:
Đáp án D
PTHH:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
Ta có:
Câu 3. Cho dung dịch NH4NO3 tác dụng vừa đủ với dung dịch hiđroxit của kim loại R (tº), thu được 4,48 lit khí (đktc) và dung dịch X. Cô cạn dung dịch X thu được 26,1 gam muối khan. Kim loại R là:
A. Ba
B. Ca
C. Na
D. K
Lời giải:
Đáp án A
Gọi hóa trị của R là
⇒R =137 và n = 2⇒R là Ba
Câu 4.Cho quỳ tím vào dung dịch NH31M, quỳ tím chuyển sang màu gì?
A. Xanh.
B. Đỏ.
C. Không đổi màu.
D. Hồng.
Lời giải:
Đáp án A
Câu 5. Khí N2O là sản phẩm của phản ứng nhiệt phân muối nào sau đây?
A. NaNO3.
B. NH4NO3.
C. NH4NO2.
D. Cu(NO3)2.
Lời giải:
Đáp án C
Câu 6. Có 4 dung dịch đựng trong 4 lọ mất nhãn là: (NH4)2SO4, NH4Cl, Na2SO4, KOH. Nếu chỉ được phép sử dụng một thuốc thử để nhận biết 4 dung dịch trên, có thể dùng dung dịch:
A. AgNO3
B. Ba(OH)2
C. KOH
D. BaCl2
Lời giải:
Đáp án B
Xem thêm các phương trình hóa học khác:
NH4NO3 ra NH3 | NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
KOH ra KNO3 | KOH + NH4NO3 → KNO3+ NH3 + H2O | NH4NO3 ra NH3
KOH + H3PO4 → K3PO4 + H2O | KOH ra K3PO4
CO2 + KOH → K2CO3 + H2O | CO2 ra K2CO3
SO2 + KOH → K2SO3 + H2O | SO2 ra K2SO3