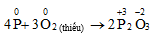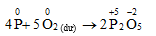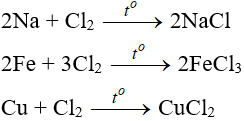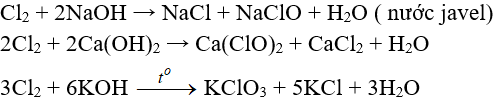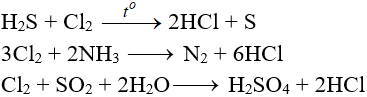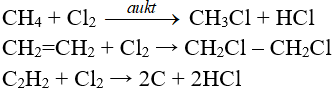Phản ứng P + Cl2 → PCl3
1. Phương trình phản ứng P ra PCl3
2P + 3Cl2 → 2PCl3
2. Điều kiện phản ứng P tác dụng Cl ra PCl3
Nhiệt độ
Điều kiện khác: thiếu clo
3. Hiện tượng đốt cháy photpho trong khí Cl2 thiếu thì sản phẩm thu được là
Photpho tác dụng dễ dàng với khi Clo khi đốt nóng, màu vàng lục của khí Clo (Cl2) nhạt dần khi phản ứng xảy ra.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của P (Photpho)
- Trong phản ứng trên P là chất khử.
- P là phi kim tương đối hoạt động thể hiện tính khử khi tác dụng với các phi kim hoạt động như O2, halogen, S và các hợp chất oxi hoá mạnh khác.
4.2. Bản chất của Cl2 (Clo)
Trong phản ứng trên Cl2 là chất oxi hoá.
5. Tính chất hoá học của P
P vừa có tính khử vừa có tính oxi hóa
5.1. Tính khử
a. Khử phi kim mạnh hơn:O2, Cl2, S...
- Khử O2 :
Photpho trắng tác dụng với oxi ở điều kiện thường, phản ứng tỏa năng lượng ở dạng ánh sáng → gây ra hiện tượng phát quang hóa học
Photpho đỏ chỉ tác dụng với oxi ở nhiệt độ cao
- Khử : 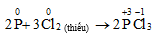
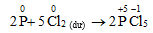
b. Khử một số hợp chất có tính oxi hóa mạnh
5.2. Tính oxi hóa
* P oxi hóa các kim loại hoạt động tạo ra photphua kim loại
6. Ứng dụng của P
+ P đỏ được dùng trong sản xuất diêm.
+ Điều chế axit photphoric, thuốc trừ sâu chứa photpho…
+ Dùng trong quân sự: sản xuất bom, đạn cháy, đạn khói…
+ Photpo còn là một nguyên tố rất cần cho con người nhất là trí thông minh, sáng tạo, phát triển xương. Cần cho cây nhất là cấy ăn quả.
7. Tính chất hóa học của Cl2
7.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
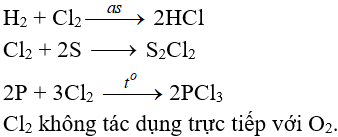
7.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
7.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
7.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
7.5. Tác dụng với chất khử khác
7.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
8. Câu hỏi vận dụng
Câu 1. Khi đốt cháy photpho trong khí Cl2 dư thì sản phẩm thu được là
A. PCl3.
B. PCl5.
C. PCl6.
D. PCl.
Lời giải:
Đáp án: B
Câu 2. Photpho tác dụng với chất nào sau đây?
A. Cl2.
B. NaCl.
C. H2O.
D. NaOH.
Lời giải:
Đáp án: A
Câu 3. Cho photpho tác dụng với các chất sau: NaOH, Ba, O2, Cl2, KClO3, HNO3 và H2SO4 đặc, nóng. Photpho tác dụng được với bao nhiêu chất trong số các chất trên ?
A. 6
B. 5
C. 4
D. 7
Lời giải:
Đáp án: A
Câu 4. Dãy chất đều phản ứng được với photpho là:
A. NaCl, Ba, O2, HNO3 đặc, nóng
B. NaCl, Ca, O2, H2SO4 đặc, nóng
C. NaOH, Ba, Cl2, HNO3 đặc, nóng
D. Ba, O2, Cl2, HNO3 đặc, nóng
Lời giải:
Đáp án: D
Câu 5. Nước clo có tính tẩy màu vì
A. khi dẫn khí clo vào nước không xảy ra phản ứng hoá học
B. clo tác dụng với nước tạo nên axit HCl có tính tẩy màu
C. clo hấp phụ được màu
D. clo tác dụng nước tạo nên axit HClO có tính tẩy màu
Lời giải:
Nước clo có tính tẩy màu vì clo tác dụng nước tạo nên axit HClO có tính tẩy màu.
Câu 6. Cho 11,2 gam bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 gam muối sắt. Khối lượng khí clo tham gia phản ứng là
A. 21,3 gam.
B. 20,50 gam.
C. 10,55 gam.
D. 10,65 gam.
Lời giải:
Đáp án : A
Áp dụng định luật bảo toàn khối lượng có: mFe pư + mClo pư = mmuối
→ mclo pư = 32,5 – 11,2 = 21,3 gam.
Xem thêm các phương trình hóa học liên quan khác:
Fe + Cl2 → FeCl3 | Fe ra FeCl3
SO2 + Cl2 + H2O → HCl + H2SO4 | SO2 ra H2SO4
H2S + Cl2 + H2O → H2SO4 + HCl | H2S ra H2SO4
KOH + Cl2 → KCl + KClO + H2O | KOH ra KCl | KOH ra KClO | Cl2 ra KCl | Cl2 ra KClO