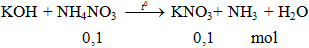Phản ứng: KOH + NH4NO3 → KNO3 + NH3 + H2O
1. Phương trình phản ứng hóa học:
KOH + NH4NO3 KNO3+ NH3 + H2O
2. Cách thực hiện phản ứng
- Đun nóng muối NH4NO3 với KOH.
3. Hiện tượng nhận biết phản ứng
- Có khí không màu, mùi khai bay ra.
4. Điều kiện phản ứng
- Phản ứng xảy ra khi đun nóng.
5. Mở rộng tính chất hóa học của KOH
- KOH là một bazơ mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
- Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
- KOH tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
- KOH tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
- KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới
KOH + Na → NaOH + K
- KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
- KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH-
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
- KOH phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
6. Bạn có biết
- Các muối amoni khác như NH4Cl, (NH4)2SO4 … cũng phản ứng với KOH giải phóng amoniac.
7. Bài tập liên quan (có đáp án)
Câu 1: Cho KOH đến dư vào 100ml dung dịch NH4NO3 2M đun nóng nhẹ. Thể tích khí thoát ra ở điều kiện tiêu chuẩn là:
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Hướng dẫn giải
Phương trình hóa học:
Ta có:
Đáp án A.
Câu 2: Cho các dung dịch sau: (NH4)2SO4, K2SO4, NH4NO3, KOH. Thực hiện thí nghiệm để nhận xét chúng và có được kết quả như sau:
|
Chất |
X |
Z |
T |
Y |
|
dd Ba(OH)2, to |
Có kết tủa xuất hiện |
Không hiện tượng |
Kết tủa và khí thoát ra |
Có khí thoát ra |
Các dung dịch X, Y, Z, T lần lượt là
A. K2SO4, (NH4)2SO4, KOH, NH4NO3
B. (NH4)2SO4, KOH, NH4NO3, K2SO4
C. KOH, NH4NO3, K2SO4, (NH4)2SO4
D. K2SO4, NH4NO3, KOH, (NH4)2SO4
Hướng dẫn giải
|
Chất |
X: K2SO4 |
Z: KOH |
(NH4)2SO4 |
Y: NH4NO3 |
|
dd Ba(OH)2, to |
Có kết tủa xuất hiện |
Không hiện tượng |
Kết tủa và khí thoát ra |
Có khí thoát ra |
- Phương trình phản ứng:
Ba(OH)2 + K2SO4 → BaSO4↓ trắng + 2KOH
Ba(OH)2 + NH4NO3: không xảy ra
Ba(OH)2 + (NH4)2SO4 → BaSO4↓ trắng + 2NH3↑ + 2H2O
Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3↑ + 2H2O
Đáp án D.
Câu 3: Muối nào sau đây phản ứng với KOH không thu được amoniac?
A. NH4Cl.
B. NH4NO3.
C. (NH4)2SO4 .
D. KNO3.
Hướng dẫn giải
KNO3 không phản ứng với KOH.
Đáp án D.
Câu 4: Hiện tượng xảy ra khi đun nóng muối NH4NO3 với KOH là
A. Có khí màu nâu đỏ bay ra.
B. Có khí mùi trứng thối thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Có khí mùi khai thoát ra.
Hướng dẫn giải
KOH + NH4NO3 
NH3 là khí có mùi khai.
Đáp án D.
Câu 5: Cho dung dịch KOH dư vào 100 ml NH4NO3 1 ml đun nóng nhẹ. Thể tích khí ở đktc thu được là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Xem thêm các phương trình hóa học khác:
NH4NO3 ra NH3 | NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
FeCl3 + KOH → Fe(OH)3 + KCl | FeCl3 ra Fe(OH)3
KOH + H3PO4 → K3PO4 + H2O | KOH ra K3PO4