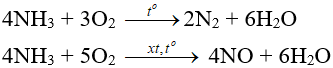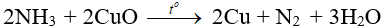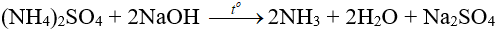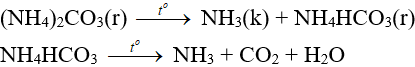Phản ứng: NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
1. Phương trình phản ứng hóa học
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
2. Hiện tượng nhận biết phản ứng
Có khí mùi khai xuất hiện.
3. Điều kiện phản ứng
Đun nóng nhẹ.
4. Mở rộng tính chất hoá học của NH3 và NH4NO3
4.1. Tính chất hóa học của NH3
a. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
b. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
c. Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
4.2. Tính chất hóa học của NH4NO3
- Dễ tan trong nước, là chất điện li mạnh.
- Trong dung dịch, ion NH4+ là axit yếu: NH4+ + H2O ⇋ NH3 + H3O+.
- Tác dụng với dung dịch kiềm:
- Dễ bị nhiệt phân hủy:
5. Cách thực hiện phản ứng
Cho NH4NO3 tác dụng với dung dịch NaOH và đun nóng nhẹ.
6. Bạn có biết
Trong phòng thí nghiệm, khí amoniac được điều chế bằng cách cho muối amoni tác dụng với chất kiềm khi đun nóng nhẹ.
7. Bài tập liên quan (có đáp án)
Câu 1. Cho dung dịch NH4NO3 tác dụng với dung dịch bazơ của kim loại thu được 4,48 lít khí (đktc) và 26,1 gam muối. Kim loại đó là
A. Ca
B. Mg
C. Cu
D. Ba
Lời giải:
Đáp án D
nNH4NO3 + M(OH)n -> M(NO3)n + nNH3 +nH2O
0,2/n 0,2
=> Mmuối = M+ 62n= 26,1 : 0,2 * n
=> M=68,5n
=> n = 2 và M là Bari.
Câu 2. Cho 37,8 gam hỗn hợp X gồm NH4NO3 và (NH4)3PO4 tác dụng hết với dung dịch Ba(OH)2 dư thu được 15,68 lít khí (đktc). Tính % khối lượng (NH4)3PO4 có trong hỗn hợp X?
A. 21,16%
B. 78,84%
C. 25,56%
D. 74,44%
Lời giải:
Đáp án B
2NH4NO3 + Ba(OH)2 → Ba(NO3)2+ 2NH3↑+ 2H2O
2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2+ 6NH3↑+6 H2O
Đặt nNH4NO3= x mol; n(NH4)3PO4= y mol → 80x + 149 y= 37,8 gam
Ta có nNH3= x + 3y = 15,68/ 22,4 mol
Giải hệ trên ta có x= 0,1 và y= 0,2 mol
→%m(NH4)3PO4= 0,2.149.100%/37,8= 78,84%
Câu 3. Hiện tượng thí nghiệm khi cho dung dịch NaOH phản ứng với dung dịch NH4NO3 đun nóng là:
A. xuất hiện khói trắng.
B. xuất hiện mùi khai.
C. không có hiện tượng gì.
D. có kết tủa trắng.
Lời giải:
Đáp án B
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Câu 4. Để nhận biết hai loại phân bón hóa học NH4NO3 và NH4Cl, ta dùng dung dịch thuốc thử nào?
A. NaOH
B. Ba(OH)2
C. AgNO3
D. BaCl2
Lời giải:
Đáp án C
Để nhận biết hai loại phân bón hóa học NH4NO3 và NH4Cl, ta dùng dung dịch AgNO3: NH4NO3 không hiện tượng, NH4Cl tạo kết tủa trắng
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
Câu 5. Muối nào sau đây phản ứng với NaOH không thu được amoniac?
A. NH4Cl
B. NH4NO3
C. (NH4)2SO4
D. NaHCO3
Lời giải:
Đáp án D
NaOH + NaHCO3 → Na2CO3 + H2O
Xem thêm các phương trình hóa học khác:
NaHCO3 + NaOH → Na2CO3 + H2O | NaHCO3 ra Na2CO3
FeCl3 + NaOH → Fe(OH)3 + NaCl | FeCl ra Fe(OH)3
NH4Cl + NaOH → NH3 + H2O + NaCl | NH4Cl ra NH3
Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O | Ba(HCO3)2 ra BaCO3