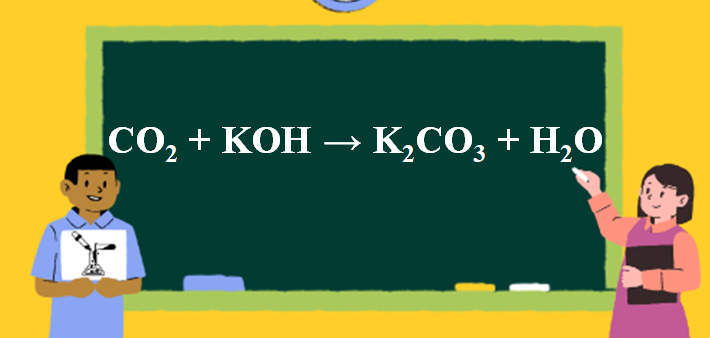Phản ứng CO2 + KOH → K2CO3 + H2O
1. Phương trình phản ứng CO2 tác dụng KOH
CO2 + 2KOH → K2CO3 + H2O
2. Bài toán CO2 dẫn vào dung dịch KOH
Khi cho CO2 (hoặc SO2) tác dụng với dung dịch KOH đều xảy ra 3 khả năng tạo muối:
CO2 + 2KOH → K2CO3 + H2O (1)
CO2 + KOH → KHCO3 (2)
Đặt T = nKOH/nCO2
Nếu T = 2 : chỉ tạo muối K2CO3
Nếu T = 1 : chỉ tạo muối KHCO3
Nếu 1 < T < 2 : tạo cả muối KHCO3 và K2CO3
Như vậy để xảy ra phương trình phản ứng (1) thì T = 2
Có những bài toán không thể tính T. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
Hấp thụ CO2 vào NaOH dư (KOH dư) chỉ tạo muối trung hòa Na2CO3 (K2CO3)
Hấp thụ CO2 vào NaOH chỉ tạo muối Na2CO3, Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa → Tạo cả 2 muối Na2CO3 và NaHCO3
Chất hấp thụ vào bình NaOH tăng:
mbình tăng = m dd tăng = m chất hấp thụ(CO2 + H2O có thể có)
Trong trường hợp không có các dữ kiện trên thì chia trường hợp để giải.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của CO2 (Cacbon dioxit)
CO2 là oxit axit tác dụng với dung dịch bazo tạo thành muối và nước.
3.2. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh phản ứng được với oxit axit.
4. Mở rộng kiến thức về CO2
4.1. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
4.2. Tính chất hóa học
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
a. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
c. CO2 còn được dùng để sản xuất ure
CO2 + 2NH3 → NH4O - CO - NH2 (amoni cacbamat)
NH4O - CO - NH2 → H2O + (NH2)2CO (180ºC; 200at)
4.3. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
5. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
5.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,...
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
5.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
5.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
5.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
5.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
5.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
5.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
6. Bài tập vận dụng
Câu 1. Cho 3,36 lít khí CO2 tác dụng với 200 ml dung dịch KOH 1M. Xác định sản phẩm thu được sau khi kết thúc phản ứng.
A. K2CO3
B. KHCO3
C. K2CO3 và KHCO3
D. Không tạo ra sản phẩm
Lời giải:
Đáp án: C
nCO2 = 3,36/22,4 = 0,15 mol
nKOH = 0,2 mol
Xét tỉ lệ T = nKOH/nCO2 = 0,2/0,15 = 1,3
1 < 1,3 < 2 : tạo cả muối KHCO3 và K2CO3
Câu 2. Cho 2,24 lít khí CO2 tác dụng với 100 ml dung dịch KOH 1M. Xác định sản phẩm thu được sau khi kết thúc phản ứng thu được m gam muối. Tính khối lượng muối thu được.
A. 10 gam
B. 12 gam
C. 20 gam
D. 15 gam
Lời giải:
Đáp án: A
nCO2 = 2,24/22,4 = 0,1 mol
nKOH = 0,1 mol
Xét tỉ lệ T = nKOH/nCO2 = 0,1/0,1 = 1
Nếu T = 1 : chỉ tạo muối KHCO3
CO2 + KOH → KHCO3 (2)
nKHCO3 = nCO2 = 0,1 mol => mKHCO3 = 0,1.100 = 10 gam
Câu 3. Hấp thụ 2,24 lít CO2 (đktc) vào 2 lít Ca(OH)2 0,1M ta thu được m gam kết tủa. Giá trị của m là
A. 10 gam.
B. 15 gam.
C. 20 gam.
D. 25 gam.
Lời giải:
Đáp án: A
→ Sau phản ứng thu được muối không tan CaCO3 và dung dịch Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Từ phương trình ta có:
→
Câu 4. Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 200ml dung dịch NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam muối. Giá trị của m là
A. 13,7 gam
B. 5,3 gam
C. 8,4 gam
D. 15,9 gam
Lời giải:
Đáp án: A
→ Dung dịch sau phản ứng chứa hỗn hợp muối Na2CO3 (a mol) và NaHCO3 (b mol).
Câu 5. Dãy chỉ gồm các oxit axit là:
A. CO, CO2, MnO2, Al2O3, P2O5
B. CO2, SO2, NO2, SO3, P2O5
C. FeO, Mn2O7, SiO2, CaO, Fe2O3
D. K2O, CaO, H2O, H2O2, ZnO
Lời giải:
Đáp án: B
A loại do có MnO2, Al2O3
C loại do có FeO, CaO, Fe2O3
D loại do có K2O, caO, ZnO
Câu 6. Dãy chất nào sau đây gồm các bazơ không bị nhiệt phân hủy?
A. Mg(OH)2, Ba(OH)2, Fe(OH)2
B. NaOH, Ba(OH)2, Al(OH)3
C. KOH, Ca(OH)2, LiOH
D. Zn(OH)2, Al(OH)3, Cu(OH)2
Lời giải:
Đáp án: C
A- chỉ có Ba(OH)2không bị phân hủy
B- sai do có Al(OH)3 bị phân hủy
C- đúng
D- sai do cả 3 chất đều bị phân hủy
Câu 7. Cặp dung dịch nào sau đây phản ứng với nhau tạo ra chất khí?
A. NH4Cl và AgNO3.
B. KOH và H2SO4.
C. Ba(OH)2 và NH4Cl.
D. Na2CO3và KOH.
Lời giải:
Đáp án: C
A- NH4Cl + AgNO3 → AgCl ↓ + NH4NO3
B- 2KOH + H2SO4 → K2SO4 + 2H2O
C- Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3 ↑ + 2H2O
D- Na2CO3 không phản ứng với KOH
Câu 8. Sục khí CO2 vào dung dịch nước vôi trong, hiện tượng xảy ra:
A. Có kết tủa ngay, lượng kết tủa tăng dần qua một cực đại rồi sau đó tan trở lại hết.
B. Một lúc mới có kết tủa, lượng kết tủa tăng dần qua một cực đại rồi lại giảm.
C. Có kết tủa ngay, nhưng kết tủa tan trở lại ngay sau khi xuất hiện.
D. Có kết tủa ngay, lượng kết tủa tăng dần đến một giá trị không đổi.
Lời giải:
Đáp án: A
Hiện tượng: Ban đầu xuất hiện kết tủa trắng, sau đó kết tủa trắng tan dần tạo dung dịch trong suốt.
Phương trình hóa học: CO2 + Ca(OH)2 → CaCO3 ↓ trắng + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Câu 9. Thổi V lít khí CO2 (đktc) vào 200ml dung dịch Ca(OH)21M thu được 12 gam kết tủa. Lọc kết tủa đun nóng dd lại thấy có kết tủa nữa. Tìm V?
A. 3,136 lít
B. 6,272 lít
C. 4,181 lít
D. 7,840 lít
Lời giải:
Đáp án: B
nCaCO3 = 12/100 = 0,12 mol
nCa(OH)2 = 0,2 mol
Do đun nóng lại thu được thêm kết tủa => nên có Ca(HCO3)2
nCaCO3 tạo thêm là 8/100 = 0,08 mol
Phương trình hóa học
CO2+ Ca(OH)2 → CaCO3+ H2O
0,12 → 0,12 → 0,12
2CO2+ Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2→ CaCO3 + CO2 + H2O
0,08 → 0,08
→ nCO2 ở phản ứng 2 là 0,08.2 = 0 ,16 mol
→ nCO2= 0,12 + 0,16 = 0,28 mol
→ V = 0,28.22,4 = 6,272 lít
Câu 10. Cho các dung dịch: NaOH, NaCl, H2SO4, Na2SO4, Ba(OH)2. Chỉ dùng thêm một thuốc thử nào sau đây để nhận biết?
A. Phenolphtalein.
B. Quỳ tím.
C. BaCl2.
D. AgNO3.
Lời giải:
Đáp án: B
Dùng quì tím nhận biết được dung dịch NaOH làm quì tím chuyển sang màu xanh, dung dịch H2SO4 làm quì tím chuyển sang màu đỏ.
Sau đó cho dùng dung dịch H2SO4 vừa nhận vào 3 mẫu còn lại;
Xuất hiện kết tủa trắng là Ba(OH)2
Ba(OH)2 + H2SO4 → BaSO4 + H2O
Không hiện tượng là NaCl và Na2SO4
Cho dung dịch Ba(OH)2 vừa nhận biết đc vào 2 mẫu còn lại:
Xuất hiện kết tủa trắng là Na2SO4
Na2SO4 + Ba(OH)2 → NaOH + BaSO4
Câu 11. Hấp thụ hoàn toàn 27,552 lít (đktc) CO2 vào m gam dd Ba(OH)2 34,2%, phản ứng hoàn toàn thu được 175,33 gam kết tủa. Giá trị m là:
A. 1060
B. 265
C. 530
D. 2120
Lời giải:
Đáp án: C
nCO2 = 27,552/22,4 = 1,23 mol; n↓ = 175,33/197 = 0,89 mol; nOH- = nCO2 + n↓ = 1,23 + 0,89 = 2,12 mol;
nBa(OH)2 = 2,12/2 = 1,06 mol
=> mdd = 1,06.171.100/34,2 = 530 gam.
Câu 12. Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan
A. 2,44 gam
B. 2,22 gam
C. 2,31 gam
D. 2,58 gam.
Lời giải:
Đáp án: C
T = 0,04/0,015 = 2,67 => tạo muối của CO32-;
nH2O = nCO2 = 0,015 mol
mcr = mCO2 + mNaOH + mKOH – mH2O = 0,015.44 + 0,02.40 + 0,02.56 – 0,015.18 = 2,31 gam
Câu 13. Sục 2,24 lít (đktc) CO2 vào 100ml hỗn hợp dung dịch gồm KOH 1M và Ba(OH)2 0,75M. Sau khi khí bị hấp thụ hoàn toàn thấy tạo m gam kết tủa. Tính m
A.19,7g
B. 14,775g.
C. 23,64g
D. 16,745g
Lời giải:
Đáp án: B
T = 0,25/0,1 = 2,5 => tạo muối của CO32-
=> nCO32-= 0,1 mol; nBa2+ = 0,075 mol
=>mBaCO3 = 0,075. 197 = 14,775 gam
Câu 14. Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,25 mol Ca(OH)2. Sản phẩm muối thu được sau phản ứng gồm?
A. Chỉ có CaCO3
B. Chỉ có Ca(HCO3)2
C. Cả CaCO3 và Ca(HCO3)2
D. Không có cả 2 chất CaCO3 và Ca(HCO3)2
Lời giải:
Đáp án: A
T = 0,5/0,1 = 5 => chỉ tạo muối của CO32-
Câu 15. Hấp thụ hoàn toàn 0,672 lít CO2 (đktc) vào 2 lít Ca(OH)2 0,01M thu được m gam kết tủa. Giá trị của m là
A. 1g.
B. 1,5g
C. 2g
D. 2,5g
Lời giải:
Đáp án: A
T = 0,04/0,03 = 4/3 => tạo 2 muối: Ca(HCO3)2 x mol và CaCO3 y mol
Ta có: x + 2y = 0,03 mol và x + y = 0,02 mol
=> x= 0,01 và y = 0,01 => m =0,01.100 =1g
Xem thêm các phương trình hóa học liên quan khác:
CO2 + Ca(OH)2 → CaCO3 + H2O | CO2 ra CaCO3
CO2 + NaOH → Na2CO3 + H2O | NaOH ra Na2CO3
CO2 + Ba(OH)2 → BaCO3 + H2O | CO2 ra BaCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2 | CaCO3 ra Ca(HCO3)2
CO2 + H2O → H2CO3 | CO2 ra H2CO3