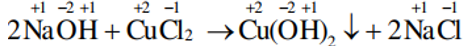Lí thuyết về phân loại phản ứng hóa học
1. Lí thuyết
1.1 Khái niệm
Phản ứng hóa học là:
- Phản ứng hóa học là quá trình biến đổi từ chất này sang chất khác.
- Chất bị biến đổi trong phản ứng là chất phản ứng hay chất tham gia.
- Chất mới sinh ra là sản phẩm.
1.2 Phân loại
- Phản ứng hoá hợp
4P + O2 → P2O5
Là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
Tгопg phản ứng hoá hợp, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
- Phản ứng phân huỷ
2Fe(OH) 3 → Fe2 O3 + 3H2 O
Là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
Trong phản ứng phân huý, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thav đổi.
- Phản ứng thế
Là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất
Fe + HCl → FeCl2 + H2
Trong hoá học vô cơ, phản ứng thế bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
- Phản ứng trao đổi
Là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
1.3 Điều kiện và dấu hiệu nhận biết phản ứng hóa học xảy ra
Điều kiện để có phản ứng hóa học xảy ra
- Chất tham gia phản ứng tiếp xúc nhau.
- Có thể cần có nhiệt độ.
- Có thể cần xúc tác thích hợp.
Dấu hiệu có thể nhận biết phản ứng hóa học xảy ra
- Có thể thay đổi màu sắc, trạng thái, mùi.
- Tỏa nhiệt, thu nhiệt hoặc phát sáng.
- Tạo ra kết tủa, bay hơi, hoặc đổi màu.
2. Bài tập vận dụng
Bài 1. Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. Fe2O3+ 6HNO3 → 2Fe(NO3)3 + 3H2O
B. H2SO4+ K2O → K2SO4 + 2H2O
C. Fe2O3 + 3CO → 2Fe + 3CO2
D. 2AgNO3 + CaCl2 → Ca(NO3)2 + 2AgCl ↓
Đáp án: C. Fe2O3 + 3CO → 2Fe + 3CO2
Loại A. Fe2O3+ 6HNO3 → 2Fe(NO3)3 + 3H2O
Phản ứng oxit bazo tác dụng với axit
Loại B. H2SO4+ K2O → K2SO4 + 2H2O
Phản ứng oxit bazo tác dụng với axit
C. Fe2O3 + 3CO → 2Fe + 3CO2
Loại D. 2AgNO3 + CaCl2 → Ca(NO3)2 + 2AgCl ↓
Phản ứng trao đổi
Bài 2. Phản ứng nào sau đây là phản ứng thế?
A. 4S + 8NaOH → Na2SO4 + 3Na2S + 4H2O
B. Cl2 + 2KBr → 2KCl + Br2
C. 3Zn + 8HNO3 → 3Zn(NO3)2+ 2NO + 4H2O
D. Fe(NO3)2 + AgNO3 → Fe(NO3)3+ Ag
Đáp án: B. Cl2 + 2KBr → 2KCl + Br2
Bài 3. Trong hóa học vô cơ, loại phản ứng hoá học nào sau đây luôn luôn không phải là phản ứng oxi hoá-khử?
A. phản ứng hóa hợp
B. phản ứng phân hủy
C. phản ứng thế
D. phản ứng trao đổi
Đáp án: D. phản ứng trao đổi
Trong hóa học vô cơ, loại phản ứng hoá học nào sau đây luôn luôn không phải là phản ứng oxi hoá-khử chính là phản ứng trao đổi
Bài 4. Phản ứng nhiệt phân muối thuộc phản ứng:
A. oxi hóa – khử
B. không oxi hóa – khử
C. oxi hóa – khử hoặc không
D. thuận nghịch
Đáp án: C. oxi hóa – khử hoặc không.
Phản ứng nhiệt phân muối thuộc phản ứng: oxi hóa – khử hoặc không.
Bài 5. Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử?
A. NH4NO2 → N2 + 2H2O
B. CaCO3 → CaO + CO2
C. 8NH3 + 3Cl2 → N2 + 6NH4Cl
D. 2NH3 + 3CuO → N2 + 3Cu + 3H2O
Đáp án: A. NH4NO2 → N2 + 2H2O
Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử:
NH4NO2 → N2 + 2H2O
Bài 6. Phản ứng nào sau đây là phản ứng thế?
A. CuO + HCl → CuCl2 + H2O
B. Fe + 2HCl → FeCl2 + H2
C. 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
D. Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
Đáp án: B. Fe + 2HCl → FeCl2 + H2
Bài 7. Phản ứng nào sau đây vừa là phản ứng hóa hợp, vừa là phản ứng oxi hóa – khử?
A. CaO + H2O → Ca(OH)2
B. 2NO2 → N2O4
C. 2NO2 + 4Zn → N2 + 4ZnO
D. 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Đáp án: D. 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Bài 8. Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử?
A. NH4NO2 → N2 + 2H2O
B. CaCO3 → CaO + CO2
C. 8NH3 + 3Cl2 → N2 + 6NH4Cl
D. 2NH3 + 3CuO → N2 + 3Cu + 3H2O
Đáp án: A. NH4NO2 → N2 + 2H2O
Xem thêm các dạng bài tập Hóa học hay khác:
Lí thuyết tổng hợp về tơ capron (2024) chi tiết nhất
Lí thuyết tổng hợp về tơ lapsan (2024) chi tiết nhất
Lí thuyết tổng hợp về tơ nhân tạo (2024) chi tiết nhất
Lí thuyết tổng hợp về tơ tổng hợp (2024) chi tiết nhất
Lí thuyết về areniut (2024) hay, chi tiết nhất