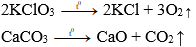Lí thuyết về muối
1. Lí thuyết
1.1 Phân loại
Muối gồm có năm loại:
+ Muối axit: Muối có anion gốc axit còn khả năng phân li cho ion H+.
Ví dụ: NaHCO3; NaH2PO4; NaHSO4; ...
+ Muối trung hoà: Muối có anion gốc axit không còn khả năng phân li cho ion H+.
Ví dụ: NaCl , (NH4)2SO4, Na2CO3, ...
+ Muối bazo: Muối có nhóm –OH có thể thay thế bằng gốc axit.
Ví dụ: Mg(OH)Cl; Fe(OH)2Cl, ...
+ Ngoài ra còn kể đến một số muối kép như: HCl.NaCl; KCl.MgCl.6H2O; K2SO4.Al2(SO4)3, ...
+ Muối phức: [Ag(NH3)2]Cl; [Cu(NH3)4]SO4, ...
1.2 Tính chất hóa học
Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Tác dụng với axit
Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ:
AgNO3 + HCl → AgCl ↓ + HNO3
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Tác dụng với dung dịch muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
AgNO3 + NaCl → NaNO3 + AgCl↓
BaCl2 + K2SO4 → 2KCl + BaSO4 ↓
Tác dụng với dung dịch bazơ
Dung dịch muối có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ:
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
2. Bài tập vận dụng
Bài 1:. Trộn 2 dung dịch muối nào sau đây sẽ không xuất hiện kết tủa ?
A. BaCl2, Na2SO4.
B. Na2CO3, CaCl2.
C. BaCl2, AgNO3.
D. NaCl, K2SO4.
Lời giải:
Đáp án D
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2NaCl
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
NaCl + K2SO4 → không phản ứng.
Bài 2: Cặp chất nào sau đây không thể tồn tại trong cùng một dung dịch?
A. BaCl2, MgSO4.
B. KCl, Na2SO4
C. CaCl2, NaNO3.
D. ZnSO4, H2SO4
Lời giải:
Đáp án A
BaCl2 và MgSO4 không thể tồn tại trong cùng một dung dịch vì xảy ra phương trình phản ứng:
BaCl2 + MgSO4 → BaSO4 ↓ + MgCl2
Bài 3: Cho Na2CO3 vào từng dung dịch sau: NaCl, BaCl2, Ba(NO3)2, Ca(NO3)2. Số phản ứng xảy ra là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án C
Na2CO3 + NaCl → không phản ứng.
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3.
Bài 4: Cho 20ml dung dịch AgNO3 1M vào lượng dư dung dịch KCl. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
A. 28,7 gam.
B. 2,87 gam.
C. 27,8 gam.
D. 2,78 gam.
Lời giải:
Đáp án B
Ta có: nAgNO3= 0,02.1 = 0,02 mol
Phương trình phản ứng:
AgNO3 + KCl → KNO3 +AgCl ↓
0,02 ………………………….0,02 (mol)
Khối lượng kết tủa tạo thành: mAgCl = 0,02.(108 + 35,5) = 2,87 (g)
Bài 5: Biết 200g dung dịch Na2CO3 10,6% tác dụng vừa đủ với 200 ml dung dịch Ca(NO3)2. Nồng độ dung dịch Ca(NO3)2 đã dùng là
A. 1M.
B. 2M.
C. 0,1M.
D. 0,2M.
Lời giải:
Đáp án A
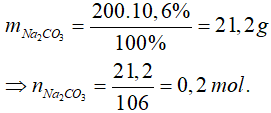
Phương trình hoá học:
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
0,2................0,2 mol
Nồng độ dung dịch Ca(NO3)2 đã dùng là:
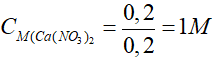
Bài 6: Cho 26,1 gam K2SO4 vào dung dịch chứa 20,8 gam BaCl2, sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 23,3.
B. 2,33.
C. 34,95.
D.3,495.
Lời giải:
Đáp án A
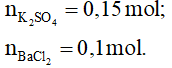
Phương trình hóa học:
K2SO4 + BaCl2 → BaSO4↓ + 2KCl
0,15 0,1 mol
Có
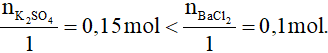
Vậy sau phản ứng BaCl2 hết; số mol kết tủa tính theo BaCl2.
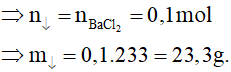
Bài 7: Cho 500ml dung dịch NaCl 0,2M tác dụng với 600ml dung dịch AgNO3 0,2M. Đến khi phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được sau phản ứng là
A. 143,5 gam.
B. 134,5 gam.
C. 14,35 gam.
D. 13,45 gam.
Lời giải:
Đáp án C
nNaCl = 0,5.0,2 = 0,1 mol; nAgNO3= 0,6.0,2 = 0,12 mol
Phương trình hóa học:
NaCl + AgNO3 → AgCl↓ + NaNO3
Xét tỷ lệ
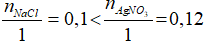
Vậy NaCl phản ứng hết, AgNO3 còn dư.
Ta có: nAgCl = nNaCl = 0,1 mol → mAgCl = 14,35 gam.
Bài 8: Cho 35,4 gam hỗn hợp gồm 2 muối Na2SO4 và Na2CO3 tác dụng hoàn toàn với dung dịch BaCl2 sau phản ứng thu được 62,7 gam kết tủa. Khối lượng mỗi muối trong hỗn hợp ban đầu là
A. 24,2 gam và 11,2 gam.
B. 12,4 gam và 22,1 gam.
C. 20,2 gam và 15,2 gam.
D. 14,2 gam và 21,2 gam.
Lời giải:
Đáp án D
Gọi x và y lần lượt là số mol của Na2SO4 và Na2CO3 trong hỗn hợp ban đầu.
Ta có: 142x + 106y = 35,4 (1)
Phương trình hóa học:
Na2SO4 + BaCl2→ BaSO4 + 2NaCl
x mol …………. x mol
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
y mol…………… y mol
Tổng khối lượng kết tủa là 233x + 197y = 62,7 (2)
Từ (1) và (2) được x = 0,1 mol và y = 0,2 mol
Khối lượng Na2SO4 là 0,1.142= 14,2 gam
Khối lượng Na2CO3 là 0,2.106= 21,2 gam
Bài 9: Cho 500ml dung dịch A gồm BaCl2 và MgCl2 phản ứng với 120ml dung dịch Na2SO4 0,5M, đến khi phản ứng xảy ra hoàn toàn thu được 11,65g kết tủa. Lọc bỏ kết tủa đem phần dung dịch cô cạn thu được 16,77g hỗn hợp muối khan. Nồng độ mol/l các chất trong dung dịch A là
A. 0,1M và 0,2M.
B. 0,01M và 0,02M.
C. 0,5M và 0,1M.
D. 0,05M và 0,02M.
Lời giải:
Đáp án A
Cho hỗn hợp A phản ứng với BaCl2 chỉ có Na2SO4 phản ứng.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,05 ← 0,05 ← 0,05 → 0,1 mol
Số mol Na2SO4 còn dư là 0,06 – 0,05 = 0,01 mol
Số mol MgCl2
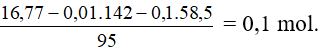
Vậy trong 500ml dd A có 0,05 mol BaCl2 và 0,1 mol MgCl2.
→ Nồng độ của BaCl2 = 0,05/0,5 = 0,1M và nồng độ của MgCl2 =0,1/0,5 = 0,2M.
Bài 10: Trộn 10g dung dịch AgNO3 34% với 10g dung dịch Fe(NO3)2 18% đến khi phản ứng hoàn toàn thấy thu được m gam Ag. Giá trị của m là
A. 5,4 gam.
B. 10,8 gam.
C. 0,54 gam.
D. 1,08 gam.
Lời giải:
Đáp án D
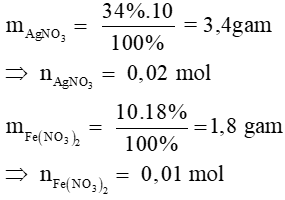
Phương trình phản ứng:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 +Ag (1)
Ta có:
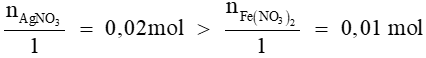
Vậy AgNO3 dư, Fe(NO3)2 hết
Từ (1) có nAg = = 0,01 mol
→ mAg = 0,01.108 = 1,08gam.
Bài tập tự luyện
Bài 1: Cho dung dịch NaCl 2M tác dụng vừa đủ với dung dịch AgNO3 1M. Thu được 28,7g kết tủa. Thể tích dung dịch NaCl và dung dịch AgNO3 cần dùng lần lượt là
A. 100ml và 200ml
B. 200ml và 200ml
C. 200ml và 100ml
D. 150ml và 300ml
Bài 2: Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 3,4 g AgNO3. Tính khối lượng chất rắn sinh ra.
A. 2,583 g
B. 2,1525 g
C. 2,87 g
D. 1,435 g
Bài 3: Cho 3,22 g ZnSO4 tác dụng với dung dịch Na2CO3 0,2M. Tính thể tích dung dịch Na2CO3 đã tham gia phản ứng.
A. 0,2 lít
B. 0,5 lít
C. 0,1 lít
D. 0,4 lít
Bài 4: Trộn 100g dung dịch AgNO3 17% với 200g dung dịch Fe(NO3)2 18% thu được kết tủa A. Tính khối lượng kết tủa A.
A. 27g
B. 16,2g
C. 10,8g
D. 21,6g
Bài 5: Cho 500ml dung dịch BaCl2 phản ứng với dung dịch Na2SO4 dư, thu được 11,65g kết tủa. Tính nồng độ mol của dung dịch BaCl2.
A. 0,1M
B. 0,2M
C. 0,3M
D. 0,4M
Bài 6: Cho 400ml dung dịch K2CO3 0,1M vào 200ml dung dịch BaCl2 0,1M đến khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 3,94 gam
B. 3,49 gam
C. 7,88 gam
D. 11,70 gam
Bài 7: Cho 16,1 g ZnSO4 tác dụng vừa đủ với dung dịch K2CO3 thu được m gam kết tủa. Tính giá trị của m.
A. 8,2
B. 10,2
C. 10,8
D. 9,9
Đáp án D
Bài 8: Trộn 2 dung dịch muối nào sau đây sẽ không xuất hiện kết tủa?
A. BaCl2, Na2SO4
B. Na2CO3, CaCl2
C. BaCl2, AgNO3
D. NaCl, K2SO4
Bài 9: Cho 11,7g NaX (X là 1 halogen) vào dung dịch AgNO3 dư, thu được 28,7g kết tủa. Tìm công thức của NaX.
A. NaBr
B. NaF
C. NaI
D. NaCl
Bài 10: Có 1 lit dung dịch hỗn hợp gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng vừa đủ với 53,4g hỗn hợp BaCl2 và CaCl2. Sau khi các phản ứng kết thúc thu được a g kết tủa. Giá trị của a là
A. 28,7
B. 49,55
C. 28,55
D. 31,2
Đáp án tham khảo
|
1A |
2C |
3C |
4C |
5A |
6A |
7D |
8D |
9D |
10B |
Xem thêm các bài tập Hóa học hay khác:
Lí thuyết tổng hợp về tơ nhân tạo (2024) chi tiết nhất
Lí thuyết về phân loại phản ứng hóa học (2024) hay, chi tiết nhất
Lí thuyết về kim loại (2024) chi tiết nhất