Xét phản ứng phân hủy N2O5 theo phương trình hóa học:Tính tốc độ trung bình của phản ứng trong khoảng
228
31/01/2024
OT6.8 trang 74 SBT Hóa học 10. Xét phản ứng phân hủy N2O5 theo phương trình hóa học:
, xảy ra ở 56oC cho kết quả theo bảng:
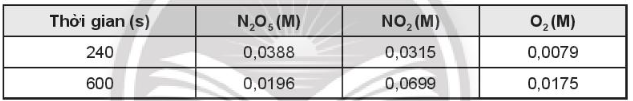
Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
Trả lời
Tốc độ trung bình của phản ứng được tính trong khoảng thời gian t1 = 240 (s) đến t2 = 600 (s) ⇒ ∆t = 600 – 240 = 360 (s); ∆C = Csau – Cđầu
Tốc độ trung bình của phản ứng
Xem thêm các bài giải sách bài tập Hóa học lớp 10 sách Chân trời sáng tạo chi tiết khác
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Ôn tập chương 6
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 18: Hydrogen halide và một số phản ứng của ion halide
Ôn tập chương 7

