Giải Sách bài tập Hóa học 10 Bài Bài 18: Hydrogen halide và một số phản ứng của ion halide
Bài 18.1 trang 79 SBT Hóa học 10. Hydrogen halide có nhiệt độ sôi cao nhất là
A. HI
B. HCl
C. HBr
D. HF
Lời giải:
Đáp án đúng là: D.
HF có nhiệt độ sôi cao bất thường so với các chất còn lại trong dãy. Điều này được giải thích chủ yếu là do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau.
Bài 18.2 trang 79 SBT Hóa học 10. Phân tử có tương tác van der Waals lớn nhất là
A. HCl
B. HI
C. HBr
D. HF
Lời giải:
Đáp án đúng là: B.
Sự tăng kích thước và số lượng electron trong phân tử từ HF đến HI làm tăng tương tác van der Waals giữa các phân tử.
Phân tử HI có tương tác van der Waals lớn nhất.
Bài 18.3 trang 79 SBT Hóa học 10. Hydrohalic acid có tính acid mạnh nhất là
B. HBr
C. HI
D. HCl
Lời giải:
Đáp án đúng là: C.
HI có tính axit mạnh nhất.
Tính acid của các dung dịch HX tăng theo dãy từ HF đến HI. Trong đó, hydrofluoric acid là acid yếu do chỉ phân li một phần trong nước. Còn HCl; HBr; HI được xếp vào loại acid mạnh do phân li hoàn toàn trong nước. Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy trên là do sự giảm độ bền liên kết theo thứ tự: HF; HCl; HBr; HI.
Bài 18.4 trang 79 SBT Hóa học 10. Hydrohalic acid có tính ăn mòn thủy tinh là
A. HBr
B. HI
C. HCl
D. HF
Lời giải:
Đáp án đúng là: D.
HF có khả năng ăn mòn thủy tinh.
4HF + SiO2 → SiF4 + 2H2O
SiO2 là thành phần chính của thủy tinh.
Bài 18.5 trang 79 SBT Hóa học 10. Liên kết hydrogen của phân tử nào được biểu diễn đúng?
A. … H – I … H – I … H – I …
B. … H – Cl … H – Cl … H – Cl …
C. … H – Br … H – Br … H – Br …
D. … H – F … H – F … H – F …
Lời giải:
Đáp án đúng là: D.
Giữa các phân tử HF tồn tại liên kết hydrogen với nhau.
Bài 18.6 trang 79 SBT Hóa học 10. Ion halide được sắp xếp theo chiều giảm dần tính khử:
A. F−,Cl−,Br−,I−
B. I−,Br−,Cl−,F−
C. F−,Br−,Cl−,I−
D. I−,Br−,F−,Cl−
Lời giải:
Đáp án đúng là: B.
Tính khử của các ion halide giảm dần theo thứ tự: I-; Br-; Cl-; F‑.
Bài 18.7 trang 79 SBT Hóa học 10. Hydrogen halide có nhiều liên kết hydrogen nhất với nước là:
A. HF
B. HCl
C. HBr
D. HI
Lời giải:
Đáp án đúng là: A.
HF có thể tạo ra liên kết hydrogen với nước.
Bài 18.8 trang 79 SBT Hóa học 10. Chất hay ion nào có tính khử mạnh nhất?
A. Cl2
B. Cl-
C. I2
D. I-
Lời giải:
Đáp án đúng là: D.
I- có tính khử mạnh nhất.
Bài 18.9 trang 79 SBT Hóa học 10. Dung dịch dùng để nhận biết các ion halide là:
A. Quỳ tím
B. AgNO3
C. NaOH
D. HCl
Lời giải:
Đáp án đúng là: B.
Dung dịch dùng để nhận biết các ion halide là: AgNO3.
Nếu ion là F-: không có phản ứng xảy ra.
Nếu ion là Cl-: xuất hiện kết tủa trắng.
Nếu ion là Br-: xuất hiện kết tủa vàng nhạt.
Nếu ion là I-: xuất hiện kết tủa vàng đậm.
A. hóa màu đỏ
B. hóa màu xanh
C. mất màu tím
D. không đổi màu
Lời giải:
Đáp án đúng là: A.
HBr + NaOH → NaBr + H2O
Do nHBr > nNaOH nên dung dịch sau phản ứng làm quỳ tím chuyển sang màu đỏ.
A. NaCl
B. HCl
C. KMnO4
D. KClO3
Lời giải:
Đáp án đúng là: B.
Trong phòng thí nghiệm, chlorine được điều chế bằng cách oxi hóa HCl thành Cl2.
Bài 18.12 trang 80 SBT Hóa học 10. Cách thu khí hydrogen halide trong phòng thí nghiệm phù hợp là:
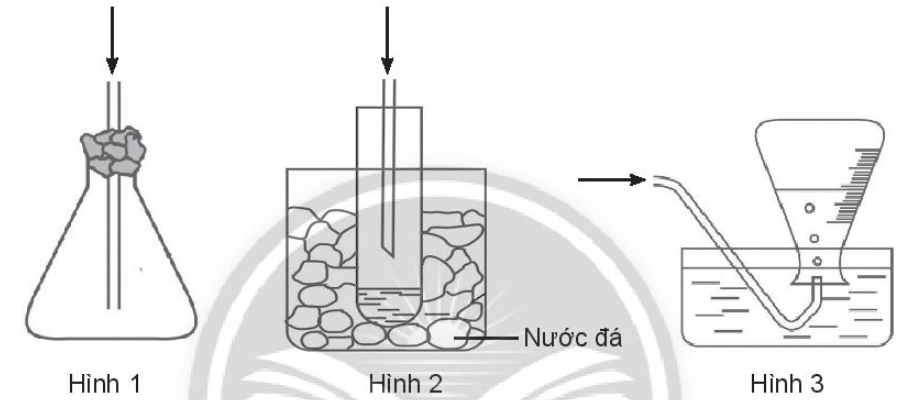
A. Hình 1
B. Hình 2
C. Hình 3
D. Hình 1 và 2
Lời giải:
Đáp án đúng là: A.
Cl2 nặng hơn không khí nên thu khí Cl2 bằng cách đẩy không khí và đặt ngửa bình.
Không thu Cl2 bằng phương pháp đẩy nước vì một phần khí Cl2 có thể tan trong nước và một phần khí Cl2 có thể tác dụng với nước.
Bài 18.13 trang 80 SBT Hóa học 10. Chọn phát biểu không đúng:
A. Các hydrogen halide tan tốt trong nước tạo dung dịch acid.
B. Ion F- và Cl- không bị oxi hóa bởi dung dịch H2SO4 đặc.
C. Các hydrogen halide làm quỳ tím hóa đỏ.
D. Tính acid của các hydrohalic acid tăng dần từ HF đến HI.
Lời giải:
Đáp án đúng là: C.
Các hydrogen halide không làm quỳ tím hóa đỏ.
Lời giải:
Hydrogen chloride được điều chế bằng cách cho tinh thể sodium chloride tác dụng với sulfuric acid đặc, được gọi là phương pháp sulfate hoá. Phương pháp sulfate hoá điều chế được HF và HCl, vì ion F-, Cl- có tính khử không đủ mạnh để khử dung dịch H2SO4 đặc. Ion Br-, I- có tính khử mạnh hơn F-, Cl- nên khử được H2SO4 đặc, tạo ra Br2 và I2, không thu được HBr, HI. Để điều chế HBr và HI, có thể thay thế H2SO4, bằng acid H3PO4 đặc:
2NaBr(s)+H3PO4(l)
Hoặc đun nóng hỗn hợp khí H2 và hơi Br2:
Lời giải:
HBr và HI đều là chất khử mạnh, sau một thời gian sử dụng, ảnh hưởng của không khí, oxygen trong không khí oxi hoá 2 ion Br- và I- thành halogen tương ứng là Br2 có màu vàng, I2 trong dung dịch I- có màu vàng đậm, dung dịch sẫm màu nhanh hơn.
Bài 18.16 trang 81 SBT Hóa học 10. Cho bảng thông tin sau:
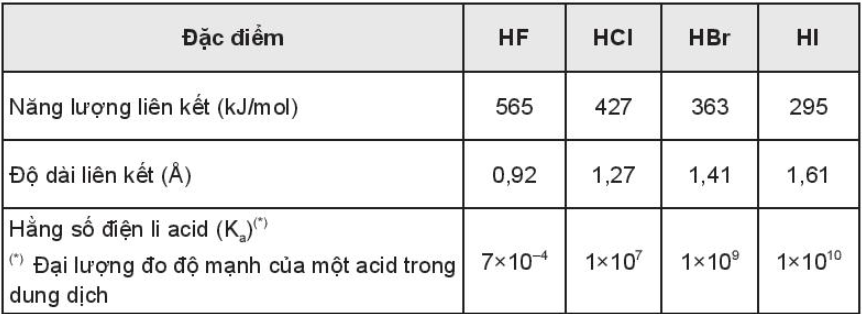
a. Sắp xếp theo thứ tự giảm dần tính acid của các hydrohalic acid.
b. Dựa vào bảng thông tin, giải thích thứ tự tính acid của các hydrohalic acid.
Lời giải:
a) Theo chiều từ HF đến HI, giá trị Ka tăng dần nên tính acid tăng dần. Vậy tính acid giảm dần theo thứ tự: HI > HCl > HBr > HF.
b) Năng lượng liên kết càng lớn, độ dài liên kết H - X càng ngắn, liên kết càng bền, trong dung dịch, tính acid càng yếu. Từ HF đến HI, năng lượng liên kết giảm, độ dài liên kết sẽ tăng, nên trong dung dịch, tính acid cũng tăng dần.
a. Khối lượng magnesium thêm vào là bao nhiêu?
b. Tính khối lượng muối và thể tích khí hydrogen (đkc) được tạo ra.
Lời giải:
Phương trình hoá học của phản ứng:
Đặt x là số mol của Mg cho vào dung dịch HCl
Áp dụng định luật bảo toàn khối lượng:
mMg + mdung dịch HCl = mdung dịch sau phản ứng + mHydrogen
⇒ 24x + 100 = 105,5 + 2x - x = 0,25 (mol)
a) mMg = 0,25 × 24 = 6 (g)
b) Khối lượng MgCl2 = 0,25 × 95 = 23,75 (g)
Thể tích H2 = 0,25 × 24,79 = 6,2(L)
Lời giải:
Nhóm trẻ sơ sinh, khối lượng NaCl cần thiết là 0,3 g, khối lượng Cl- tương ứng là:
Nhóm trẻ dưới 1 tuổi, khối lượng NaCl cần thiết là 1,5 g, khối lượng Cl- tương ứng là:
m = 182 × 5 = 910 (mg)
Nhóm trẻ dưới 2 tuổi, khối lượng NaCl cần thiết là 2,3 g, khối lượng Cl- tương ứng là:
Lời giải:
- Trong 100 gram muối i-ốt có chứa hàm lượng iodide là 2 200 ;
+ Hàm lượng iodide tối thiểu ở mức 66 /ngày, thì lượng muối i-ốt cần dùng là:
+ Hàm lượng iodide tối đa ở mức 110 /ngày, thì lượng muối i-ốt cần dùng là:
+ Vậy, đối với loại muối i-ốt có hàm lượng iodide là 2 200 /100 gam muối,lượng muối cần dùng mỗi ngày từ 3 - 5 gam.
- Trong 100 gram muối i-ốt có chứa hàm lượng iodide là 2500 ;
+ Hàm lượng iodide tối thiểu ở mức 66 /ngày, thì lượng muối i-ốt cần dùng là:
+ Hàm lượng iodide tối đa ở mức 110 /ngày, thì lượng muối i-ốt cần dùng là:
+ Vậy, đối với loại muối i-ốt có hàm lượng iodide là 2500 /100 gam muối, lượng muối cần dùng mỗi ngày từ 2,64 – 4,4 gam.
Bài 18.20 trang 82 SBT Hóa học 10. Rong biển, còn gọi là tảo bẹ, loài sinh vật sống dưới biển, được xem là nguồn thực phẩm có giá trị dinh dưỡng cao cho con người. Rong biển khô cung cấp đường, chất xơ, đạm, vitamin A, vitamin B2 và muối khoáng. Trong đó, thành phần được quan tâm hơn cả là nguyên tố vi lượng iodine. Trung bình, trong 100 gam tảo bẹ khô có chứa khoảng 1 000 µg iodine. Để sản xuất 1 tấn iodine thì cần bao nhiêu tấn tảo bẹ khô?
Có khoảng 1000 (10-3 g) iodide trong 100 gam tảo bẹ khô
Để sản xuất 1 tấn ion iodide (I-) cần khối lượng tảo bẹ khô là:
tấn = 0,1 triệu tấn
Bài 18.21 trang 82 SBT Hóa học 10. Ninh Thuận là tỉnh có 3 trong số 7 đồng muối lớn của cả nước là Cà Ná, Tri Hải và Đầm Vua, sản lượng muối của Ninh Thuận chiếm khoảng 50% sản lượng muối cả nước. Nghề làm muối truyền thống có quy trình: cải tạo ô ruộng muối, dẫn nước biển vào, phơi nắng để nước biển bốc hơi và thu hoạch muối. Sản lượng muối hằng năm đạt hơn 426 500 tấn (giai đoạn 2021 – 2025), tăng trưởng 650 000 tấn (đến năm 2030) đảm bảo cho yêu cầu phát triển công nghiệp, tạo việc làm cho lực lượng lao động địa phương (theo Thông tấn xã Việt Nam).
Nước biển từ biển và đại dương có độ mặn khoảng 3,5% (độ mặn không đồng nhất trên toàn cầu, phần lớn từ 3,1 – 3,8%), với khối lượng riêng 1,02 – 1,03 g/mL, nghĩa là mỗi lít nước biển có khoảng 36 g muối. Độ mặn được tính bằng tổng lượng (đơn vị gam) hòa tan của 11 ion chính (chiếm 99,99%) là:
có trong 1 kg nước biển, trong đó ion Cl- (55,04%), Na+ (30,61%), SO42- (7,68%) và Mg2+ (3,69%).
a. Để khai thác được sản lượng 426 500 tấn/năm như hiện tại và 650 000/ năm (đến năm 2030) thì thể tích nước biển cần dẫn vào ruộng muối là bao nhiêu? (Tính toán nhằm cung cấp số liệu để tính diện tích ruộng muối, từ đó xây dựng quy trình sản xuất để đạt năng suất cao hơn, …)
b. Tính khối lượng ion chloride được khai thác từ nước biển hàng năm.
Lời giải:
a) Mỗi lít nước biển chứa khoảng 36 g muối. Để thu được 426 500 tấn muối/ năm thì thể tích nước biển cần dẫn vào ruộng muối là:
Để đạt được 650 000 tấn/ năm vào năm 2030, thì thể tích nước biển cần là:
b) Hàm lượng ion Cl- chiếm khoảng 55,04%, khối lượng Cl- được khai thác hàng năm là: mCl- = 426 500 × 55,04% = 234 745,6 (tấn)
Với khối lượng 650 000 tấn, khối lượng Cl- được khai thác là:
mCl-= 650 000 × 55,04% = 357 760 (tấn).
Các phép toán bỏ qua sai số của cân phân tích, cân kĩ thuật, có các sai số từ 1-5 số lẻ:
0,1g; 0,01g; 0,001g; 0,0001g; 0,00001g.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học




