Giải Sách bài tập Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 17.1 trang 75 SBT Hóa học 10. Trong bảng tuần hoàn các nguyên tố hóa học, halogen thuộc nhóm
A. IA
B. IIA
C. VIIA
D. VIIIA
Lời giải:
Đáp án đúng là: C.
Halogen thuộc nhóm VIIA trong bảng tuần hoàn.
Bài 17.2 trang 75 SBT Hóa học 10. Halogen tồn tại thể lỏng ở điều kiện thường là
A. fluorine
B. bromine
C. iodine
D. chlorine
Lời giải:
Đáp án đúng là: B
Bromine tồn tại thể lỏng ở điều kiện thường.
Bài 17.3 trang 75 SBT Hóa học 10. Đơn chất halogen ở thể khí, màu vàng lục là
A. chlorine
B. iodine
C. bromine
D. fluorine
Lời giải:
Đáp án đúng là: A
Chlorine ở thể khí, màu vàng lục.
Bài 17.4 trang 75 SBT Hóa học 10. Nguyên tố có tính oxi hóa yếu nhất thuộc nhóm VIIA là:
A. chlorine
B. iodine
C. bromine
D. fluorine
Lời giải:
Đáp án đúng là: B
Nguyên tố có tính oxi hóa yếu nhất thuộc nhóm VIIA là iodine.
Bài 17.5 trang 75 SBT Hóa học 10. Cấu hình electron nguyên tử thuộc nguyên tố halogen là:
A. ns2np2
B. ns2np3
C. ns2np5
D. ns2np6
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử thuộc nguyên tố halogen là: ns2np5.
Bài 17.6 trang 75 SBT Hóa học 10. Ứng dụng nào sau đây không phải của Cl2?
A. Xử lí nước bể bơi
B. Sát trùng vết thương trong y tế
C. Sản xuất nhựa PVC
D. Sản xuất bột tẩy trắng
Lời giải:
Đáp án đúng là: B
Cl2 không được dùng để sát trùng vết thương trong y tế.
Bài 17.7 trang 75 SBT Hóa học 10. Halogen nào được dùng trong sản xuất nhựa Teflon?
A. Chlorine
B. Iodine
C. Fluorine
D. Bromine
Lời giải:
Đáp án đúng là: C.
Fluorine được dùng trong sản xuất nhựa Teflon.
Bài 17.8 trang 75 SBT Hóa học 10. Nguyên tố halogen được dùng trong sản xuất nhựa PVC là:
A. chlorine
B. bromine
C. phosphorus
D. carbon
Lời giải:
Đáp án đúng là: A.
Chlorine được dùng trong sản xuất nhựa PVC.
A. fluorine
B. chlorine
C. bromine
B. Iodine
Lời giải:
Đáp án đúng là: B.
Halogen được điều chế bằng cách điện phân có màn ngăn dung dịch muối ăn là chlorine.
A. chlorine
B. Iodine
C. bromine
D. fluorine
Lời giải:
Đáp án đúng là: B.
Iodine dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ.
Bài 17.11 trang 76 SBT Hóa học 10. Halogen nào tạo liên kết ion bền nhất với sodium?
A. Chlorine
B. Bromine
C. Iodine
D. Fluorine
Lời giải:
Đáp án đúng là: D.
Trong các halogen, fluorine có bán kính nhỏ nhất nên tạo liên kết bền nhất với sodium.
Bài 17.12 trang 76 SBT Hóa học 10. Liên kết trong phân tử đơn chất halogen là:
A. liên kết van der Waals
B. liên kết cộng hóa trị
C. liên kết ion
D. liên kết cho nhận
Lời giải:
Đáp án đúng là: B.
Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị.
Bài 17.13 trang 76 SBT Hóa học 10. Theo chiều từ F → Cl → Br → I, bán kính của nguyên tử
A. tăng dần
B. giảm dần
C. không thay đổi
D. không có quy luật
Lời giải:
Đáp án đúng là: A
Theo chiều từ F → Cl → Br → I, bán kính của nguyên tử tăng dần do số lớp electron tăng.
Bài 17.14 trang 76 SBT Hóa học 10. Đặc điểm của halogen là:
A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hóa học
B. tạo liên kết cộng hóa trị với nguyên tử hydrogen
C. nguyên tử có số oxi hóa – 1 trong tất cả hợp chất
D. nguyên tử có 5 electron hóa trị
Lời giải:
Đáp án đúng là: B.
Đặc điểm của halogen là tạo liên kết cộng hóa trị với nguyên tử hydrogen.
A sai vì nguyên tử halogen có thể góp chung electron khi hình thành liên kết hóa học.
C sai vì Cl, Br, I ngoài số oxi hóa -1 còn có các số oxi hóa +3; +5; +7 trong hợp chất.
D sai vì halogen có 7 electron hóa trị.
Bài 17.15 trang 76 SBT Hóa học 10. Phát biểu nào sau đây là không đúng?
A. Trong tự nhiên, không tồn tại đơn chất halogen.
B. Tính oxi hóa của đơn chất halogen giảm dần từ F2 đến I2.
C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu.
D. Fluorine có tính oxi hóa mạnh hơn chlorine, oxi hóa Cl- trong dung dịch NaCl thành Cl2.
Lời giải:
Đáp án đúng là: D
Cho F2 vào dung dịch NaCl; F2 oxi hóa nước có trong dung dịch:
2F2 + 2H2O → 4HF + O2
Bài 17.16 trang 76 SBT Hóa học 10. Giá trị độ âm điện của halogen và hydrogen trong bảng sau:
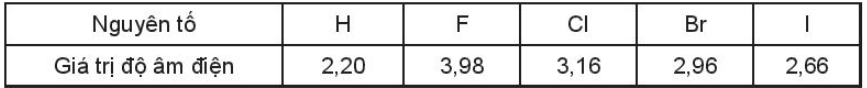
Dựa vào giá trị độ âm điện, sắp xếp theo thứ tự giảm dần khả năng liên kết của halogen với hydrogen. So sánh độ phân cực của các phân tử hydrogen halide.
Lời giải:
Từ F đến I, độ âm điện giảm dần, khả năng liên kết với nguyên tử hydrogen giảm dần.
Thứ tự giảm dần khả năng liên kết với hydrogen: F > Cl > Br > I.
|
Hydrogen halide |
HF |
HCl |
HBr |
Hl |
|
Hiệu độ âm điện trong phân tử HX |
3,98 – 2,20 = 1,78 |
3,16 – 2,20 = 0,96 |
2,96 – 2,20 = 0,76 |
2,66 – 2,20 = 0,46 |
Độ phân cực của phân tử hydrogen halide: HF > HCl > HBr > Hl.
Bài 17.17 trang 76 SBT Hóa học 10. Cho phương trình hóa học của 2 phản ứng như sau:
Cl2+2NaBr→2NaCl+Br2
Br2+2NaI→2NaBr+I2
Phương trình chứng minh tính chất nào của halogen?
Lời giải:
Cl2 có tính oxi hoá mạnh hơn Br2 nên Cl2 oxi hoá ion Br- trong dung dịch muối thành Br2.
Br2 có tính oxi hoá mạnh hơn I2, nên Br2 oxi hoá ion I- trong dung dịch muối thành I2.
Thứ tự giảm dần tính oxi hoá: Cl2 > Br2 > I2.
a. Br2+K→
b. F2+H2O→
c. Cl2+Ca(OH)2→
d. Cl2+NaI→
Nhận xét vai trò của halogen trong các phản ứng trên.
Lời giải:
a) 0Br2+2K →2K−1Br
Br2 có vai trò là chất oxi hoá (số oxi hóa giảm sau phản ứng).
b) 20F2 +2H2O →4H−1F +O2
F2 là chất oxi hoá (có số oxi hóa giảm sau phản ứng).
c) 20Cl2+2Ca(OH)2→Ca−1Cl2+Ca(+1ClO)2+2H2O
Cl2 vừa là chất oxi hoá, vừa là chất khử (số oxi hóa vừa tăng vừa giảm sau phản ứng).
d) 0Cl2+2NaI→2Na−1Cl+I2
Cl2 là chất oxi hoá (số oxi hóa giảm sau phản ứng).
Lời giải:
Bước 1: Hoà tan mẫu muối vào nước, thêm vài giọt hồ tinh bột, hỗn hợp dung dịch không màu.
Bước 2: Nhỏ vài giọt nước chlorine vào hỗn hợp dung dịch trên, xuất hiện màu xanh đen.
Cl2+2NaI→2NaCl+I2↓
Đặc trưng của iodine gặp hồ tinh bột, dung dịch có màu xanh đen.
Lời giải:
Chlorine (Cl): 1s22s22p63s23p5
Bromine (Br): 1s22s22p63s23p63d104s24p5
Iodine (l): 1s22s22p63s23p63d104s24p64d105s25p5.
Cấu hình electron lớp ngoài cùng của nguyên tử halogen: ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá -1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen, ... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine, ...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7. Vì vậy, các số oxi hoá chẵn không đặc trưng đối với halogen trong hợp chất.
Lời giải:
Cấu hình electron lớp ngoài cùng của nguyên tử halogen ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá -1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen, ... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine, ...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7.
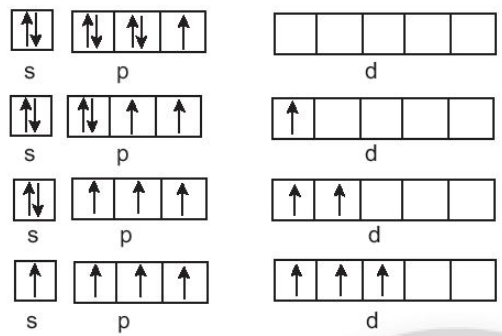
Cấu hình elecron của fluorine là 1s22s22p5, ở lớp elecron ngoài cùng có 1 electron không ghép đôi, không có ô lượng tử trống, khi hình thành liên kết hoá học, không có nguyên tử nào có độ âm điện lớn hơn fluorine đủ để cung cấp năng lượng cho quá trình kích thích, vì vậy, fluorine chỉ thể hiện mức oxi hoá -1 trong các hợp chất.
Lời giải:
Chất tan dễ dàng hoà tan trong dung môi có cùng bản chất: chất tan phân cực dễ tan trong dung môi phân cực và ngược lại. Đơn chất halogen là chất không phân cực nên dễ tan trong các dung môi không phân cực như hexane, carbon tetrachloride và ít tan trong dung môi phân cực như nước.
Lời giải:
Dựa trên kết quả thực nghiệm về độ hoà tan của các halogen trong nước ở 25°C, fluorine phản ứng mãnh liệt với nước theo phương trình:
2F2 + 2H2O → 4HF + O2 nên không tổn tại nước fluorine.
Các halogen còn lại tác dụng chậm và tan một phần trong nước tạo thành nước halogen tương ứng.
Bài 17.24 trang 77 SBT Hóa học 10. Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu.
Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh để quan sát khả năng hòa tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp.
Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên có màu da cam.
Viết phương trình hóa học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hóa học nào của halogen tương ứng?
Lời giải:
Phương trình hoá học của phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
Bước 1: NaBr là hợp chất ion, phân tử phân cực mạnh nên tan tốt trong nước, dung dịch đồng nhất, không màu.
Bước 2: Hexane là chất hữu cơ không phân cực, hỗn hợp dung dịch muối NaBr và hexane không tan vào nhau, hexane nhẹ hơn nên phân lớp phía trên.
Bước 3: Br2 được tạo ra dễ tan trong hexane, lớp chất lỏng phía trên có màu da cam.
Thí nghiệm chứng minh tính tan của đơn chất halogen trong 2 loại dung môi và chứng minh tính oxi hoá của Cl2 mạnh hơn Br2
Bài 17.25 trang 77 SBT Hóa học 10. Xác nhận đúng, sai cho các phát biểu trong bảng sau:
|
STT |
Phát biểu |
Xác nhận |
|
|
Đúng |
Sai |
||
|
1 |
Halogen vừa có tính oxi hóa, vừa có tính khử |
|
|
|
2 |
Nước chlorine và Javel đều có tính tẩy màu |
|
|
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên |
|
|
|
4 |
Cl2 có tính oxi hóa mạnh hơn Br2 |
|
|
|
5 |
Cl2 khử được I- trong dung dịch NaI thành I2 |
|
|
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen |
|
|
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon |
|
|
Lời giải:
|
STT |
Phát biểu |
Xác nhận |
|
|
Đúng |
Sai |
||
|
1 |
Halogen vừa có tính chất oxi hoá, vừa có tính khử |
|
x |
|
2 |
Nước chlorine và Javel đều có tính tẩy màu |
x |
|
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên |
|
x |
|
4 |
Cl2 có tính oxi hoá mạnh hơn Br2 |
x |
|
|
5 |
Cl2 khử được I- trong dung dịch Nal thành I2 |
|
x |
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen |
x |
|
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon |
x |
|
|
Mầm bệnh |
Thời gian tiêu diệt |
|
E.coli O157 : H7 (gây tiêu chảy ra máu, suy thận) |
< 1 phút |
|
Hepatilis A virus (gây bệnh viêm gan siêu vi A) |
16 phút |
|
Kí sinh trùng Giardia (gây tiêu chảy, đau bụng và sụt cân) |
45 phút |
Chlorine cần dùng là tổng lượng chlorine cần thiết để tiêu diệt mầm bệnh và oxi hóa các chất khử trong nước như iron, manganese, hydrogen sulfide và lượng chlorine tự do còn lại sau khoảng thời gian nhất định. Một nhà máy xử lí nước muốn làm sạch 1 lít nước thì lượng chlorine cần dùng trong 1 ngày là 11 mg để duy trì lượng chlorine tự do từ 0,1 đến 0,2 mg/L tại vòi sử dụng. Một ngày, nhà máy phải cung cấp 3 000 m3 nước xử lí, thì lượng chlorine cần dùng là bao nhiêu?
Lời giải:
1 m3 = 1000 lít
Đề xử lí 1 lít nước cần 11 mg chlorine, nhà máy xử lí 3 000 m3 nước/ ngày cần khối lượng chlorine là: 3 000 × 11 × 1 000 = 33 × 106 mg = 33 kg.
Phương pháp chuẩn độ iodine – thiosulfate được dùng để xác định dư lượng chlorrine trong thực phẩm theo phương trình:
Cl2+2KI→2KCl+I2
I2 được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình:
I2+2Na2S2O3→2NaI+Na2S4O6
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,28 mL (dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại microburet 1 mL, vạch chia 0,01 mL). Mẫu sản phẩm trên đủ tiêu chuẩn về dư lượng chlorine cho phép để xuất khẩu không? Giải thích.
Lời giải:
Phương trình hoá học của phản ứng:
Cl2+2KI→2KCl+I2
I2+2Na2S2O3→2Nal+Na2S4O6
Tính theo đơn vị mL và mg.
Số mol Na2S2O3phản ứng: n = 0,01 × 0,28 = 2,8 × 10-3 (mol)
Theo tỉ lệ các chất trong phương trình, số mol Cl2, bằng 1⁄2 số mol Na2S2O3
n = 1,4 × 10-3 (mol).
Khối lượng Cl2 có trong 100 ml dung dịch mẫu cần kiểm tra:
m = 1,4 × 10-3 × 71 = 0,0994 (mg)
Trong 1 L dung dịch mẫu, khối lượng Cl2 là: 0,0994 × 10 = 0,994 (mg).
So sánh với tiêu chuẩn chất lượng sản phẩm về dư lượng chliorine khôngvượt quá 1 mg/L, mẫu sản phẩm trên đủ tiêu chuẩn xuất khẩu.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học




