a. Tính tốc độ trung bình của phản ứng phân hủy H2O2 theo thời gian
221
31/01/2024
OT6.9 trang 74 SBT Hóa học 10. Sự phân hủy H2O2 theo phương trình hóa học: 2H2O2(aq)→2H2O(l)+O2(g), được nghiên cứu và cho kết quả tại một nhiệt độ cụ thể như sau:
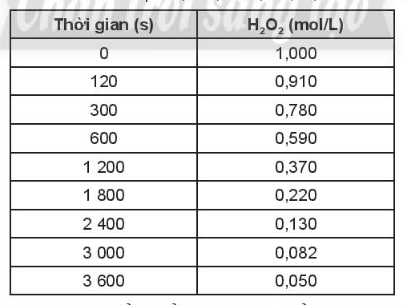
a. Tính tốc độ trung bình của phản ứng phân hủy H2O2 theo thời gian.
b. Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.
Trả lời
a) Tốc độ phản ứng phân huỷ H2O2 theo thời gian
|
Thời gian (s)
|
H2O2 (mol/L)
|
Tốc độ phản ứng (mol/L.s)
|
|
0
|
1,000
|
0
|
|
120
|
0,910
|
7,5 × 10-4
|
|
300
|
0,780
|
7,3 × 10-4
|
|
600
|
0,590
|
6,8 × 10-4
|
|
1200
|
0,370
|
5,3 × 10-4
|
|
1800
|
0,220
|
4,3 × 10-4
|
|
2400
|
0,130
|
3,6 × 10-4
|
|
3000
|
0,082
|
3,1 × 10-4
|
|
3600
|
0,050
|
2,6 × 10-4
|
b) Tốc độ phản ứng giảm dần theo thời gian. Tốc độ phản ứng phụ thuộc vào nồng độ chất tham gia, theo thời gian, nồng độ H2O2 giảm dần nên tốc độ phản ứng giảm.
Xem thêm các bài giải sách bài tập Hóa học lớp 10 sách Chân trời sáng tạo chi tiết khác
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Ôn tập chương 6
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 18: Hydrogen halide và một số phản ứng của ion halide
Ôn tập chương 7

