Cách xác định số electron lớp ngoài cùng
I. Lý thuyết và phương pháp giải
1. Khái niệm
- Trong nguyên tử, các e được sắp xếp thành từng lớp, các lớp được sắp xếp từ gần hạt nhân ra ngoài. Các e có năng lượng gần bằng nhau được sắp xếp trên cùng 1 lớp.
- Những e ở lớp trong liên kết với hạt nhân bền chặt hơn những e ở lớp ngoài. Năng lượng của e lớp trong thấp hơn năng lượng e ở lớp ngoài. Năng lượng của e chủ yếu phụ thuộc vào số thứ tự của lớp.
2. Cách xác định số electron
- Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng và nguyên tử heli không tham gia vào các phản ứng há học ( trừ 1 số điều kiện đặc biệt) ví dụ cấu hình electron của các nguyên tử này rất bền. Đó là các nguyên tố khí hiếm chỉ có một nguyên tử.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của các nguyên tố kim loại (trừ H, He, B).
- Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận electron thường là nguyên tử của nguyên tố phi kim.
- Các nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
=> Như vậy, lớp e ngoài cùng quyết định tính chất hoá học của một nguyên tố, và khi biết được cấu hình e của nguyên tử có thể dự đoán được loại nguyên tố.
| Cấu hình e lớp ngoài cùng | ns1, ns2, ns2np1 | ns2np2 | ns2np3, ns2np4, và ns2np5 | ns2np6(He : 1s2) |
| Số electron thuộc lớp ngoài cùng | 1,2,3 | 4 | 5,6 hoặc 7 | 8 (2 ở He) |
| Loại nguyên tố | Kim loại(trừ H, He, B) | Có thể là kim loại hoặc phi kim | Thường là phi kim | Khí hiếm |
| Tính chất cơ bản của nguyên tố | Tính kim loại | Có thể là tính kim loại hay tính phi kim | Thường có tính phi kim | Tương đối trơ về mặt hóa học |
II. Ví dụ minh họa
Ví dụ 1: Nguyên tử Fe có Z= 26.
+ Có 26e
+ Các e được phân bố như sau: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Có sự chèn mức năng lượng 4s < 3d
+ Sắp xếp lại các phân lớp theo từng lớp, ta được cấu hình e: 1s2 2s2 2p6 3s2 3p6 3d64s2 .
Hoặc viết gọn: [Ar] 3d6 4s2 ( [Ar] là cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước Fe ) có 4 lớp e, lớp ngoài cùng có 2 e.
Ví dụ 2: Cho biết sắt có số hiệu nguyên tử là Z = 26
a. Cấu hình electron của ion Fe2+ là :
1s2 2s2 2p6 3s2 3p6 3d6
III. Bài tập vận dụng
Bài 1. Có bao nhiêu electron ở lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử lần lượt bằng 3, 6, 9, 18?
Hướng dẫn giải
Số electron lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử bằng 3, 6, 9, 18 lần lượt là 1, 4, 7, 8. Do các nguyên tử có cấu hình electron như sau:
Z = 3: 1s22s1 ;
Z = 6 : 1s22s22p2;
Z = 9: 1s22s22p5 ;
Z = 18: 1s22s22p63s23p6.
câu 2: Sử dụng bảng tuần hoàn, hãy cho biết: Số electron lớp ngoài cùng của nguyên tử hai nguyên tố Al và S. Giải thích.
Hướng dẫn giải
- Al thuộc nhóm IIIA => Al có 3 electron ở lớp ngoài cùng
- S thuộc nhóm VIA => S có 6 electron ở lớp ngoài cùng
Bài 2: Số electron lớp ngoài cùng của các nguyên tố có Z=19; Z=16 và Z= 18 lần lượt là
A. 1, 4, 6.
B. 1, 6, 8.
C. 2, 6, 8.
D. 2, 4, 6.
Hướng dẫn giải
Z = 19 : 1s22s22p63s23p64s1
Z = 16 : 1s22s22p63s23p4
Z = 18 : 1s22s22p63s23p6
Đáp án : B
Bài 3: Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br
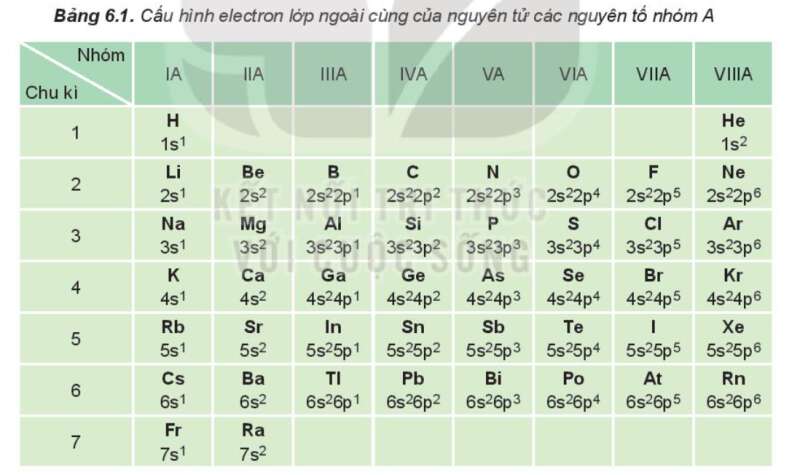
Hướng dẫn giải:
Trong bảng 6.1, nguyên tố:
+ Li nằm ở nhóm IA => Li có 1 electron lớp ngoài cùng.
+ Al nằm ở nhóm IIIA => Al có 3 electron lớp ngoài cùng.
+ Ar nằm ở nhóm VIIIA => Ar có 8 electron lớp ngoài cùng.
+ Ca nằm ở nhóm IIA => Ca có 2 electron lớp ngoài cùng.
+ Si nằm ở nhóm IVA => Si có 4 electron lớp ngoài cùng.
+ Se nằm ở nhóm VIA => Se có 6 electron lớp ngoài cùng.
+ Br nằm ở nhóm VIIA => Br có 7 electron lớp ngoài cùng.
Bài 4: Cấu hình electron của nguyên tử có Z = 16 là
A. 1s22s22p63s23p3.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p4.
D. 1s22s22p63s23p6.
Hướng dẫn giải
Nguyên tử có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4.
Đáp án: C
Bài 5: Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Hướng dẫn giải
Cấu hình electron theo orbital của nguyên tố X có thể là
Vậy X có thể là Z = 3 (Li) hoặc Z = 5 (B) hoặc Z = 9 (F).
Bài 6: Biết nguyên tử iron (kí hiệu Fe) có số hiệu nguyên tử là 26. Hãy viết cấu hình electron ion Fe2+; Fe3+.
Hướng dẫn giải:
Nguyên tử Fe có số hiệu nguyên tử là 26, nên có 26 electron.
Cấu hình electron nguyên tử Fe: 1s22s22p63s23p63d64s2.
Fe → Fe2+ + 2e
Vậy cấu hình ion Fe2+: 1s22s22p63s23p63d6
Fe → Fe3+ + 3e
Vậy cấu hình ion Fe3+: 1s22s22p63s23p63d5.
Bài 7: Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
Hướng dẫn giải:
Cấu hình electron của A và B:
- Nguyên tố A có 3 trường hợp:
+ Không có electron ở 3d:
⇒ Cấu hình electron: 1s2 2s2 2p6 3s2 3p6 4s1: Z = 19 (K)
+ Có electon ở 3d: vì 4s1 chưa bão hòa nên:
hoặc 3d bán bão hòa: 1s2 2s2 2p6 3s2 3p6 3d5 4s1:Z = 24 (Cr)
hoặc 3d bão hòa: 1s2 2s2 2p6 3s2 3p6 3d10 4s1: Z = 29 (Cu)
- Nguyên tố B: 1s2 2s2 2p6 3s2 3p5, B có Z = 17 là clo (Cl)
Bài 8: Nguyên tử A có e ở phân lớp 3d chỉ bằng một nửa phân lớp 4s.Cấu hình electron của nguyên tử A là
A. [Ar]3d14s2
B. [Ar]3d44s2
C. [Ne]3d14s2
D. [Ar]3d34s2
Hướng dẫn giải:
Số electron tối đa của phân lớp 4s là 4s2 → số e ở phân lớp 3d là 3d1
Cấu hình của nguyên tử A là [Ar]3d14s2
Đáp án: A
Bài 9: Nguyên tử M có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của M
A. 24 B. 25 C. 27 D. 29
Hướng dẫn giải:
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27.
Đáp án: C
Bài 10: Viết cấu hình electron của các ion Cu2+, N3-, Fe3+, Cl-,Al3+. Biết số thứ tự nguyên tố lần lượt là: Cu (Z = 29), N (Z = 7), Fe (Z = 26), Cl (Z = 17), Al (Z = 13).
Hướng dẫn giải:
Cu2+ = 1s2 2s2 2p6 3s2 3p6 3d9
N3- = 1s2 2s2 2p6
Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5
Cl- = 1s2 2s2 2p6 3s2 3p6
Al3+ = 1s2 2s2 2p6
Xem thêm cách làm các dạng bài hóa học hay khác:
Cách tính phần trăm số nguyên tử mỗi đồng vị (2024) hay nhất, chi tiết nhất
Cách tính khối lượng nguyên tử (2024) hay nhất, chi tiết nhất
Cách tính độ pH (2024) hay, chi tiết nhất
Cách tính nguyên tử khối trung bình (2024) chi tiết, có đáp án






