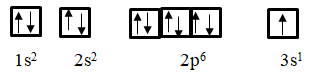
Cách xác định nhóm dựa vào cấu hình electron
1. Lí thuyết
Phương pháp xác định nhóm nguyên tố
- Viết cấu hình electron => Vị trí dựa vào số hiệu nguyên tử, số electron lớp ngoài cùng và số lớp electron
- Xác định khối nguyên tố:
+ Khối nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA: [Khí hiếm]ns1-2
+ Khối nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He): [Khí hiếm]ns2np1-6
+ Khối nguyên tố d gồm các nguyên tố thuộc nhóm B: [Khí hiếm](n-1)d1-10ns1-2
+ Khối nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn:
[Khí hiếm](n-2)f0-14(n-1)d0-2ns2
- Xác định kim loại, phi kim hay khí hiếm:
- Đối với nhóm A:
+ Có 1, 2, 3 electron ở lớp ngoài cùng => kim loại
+ Có 5, 6, 7 electron ở lớp ngoài cùng => phi kim
+ Có 8 electron ở lớp ngoài cùng => khí hiếm
- Tất cả nguyên tố nhóm B là kim loại
2. Bài tập vận dụng
Bài 1. Biết nguyên tố R thuộc chu kì 2 nhóm VA của bảng tuần hoàn. Hãy viết cấu hình electron của nguyên tử R.
Lời giải:
E thuộc chu kì 2 ⇒ Có 2 lớp electron. R thuộc nhóm VA ⇒ Có 5 electron lớp ngoài cùng ⇒ Cấu hình electron của R: ls32s22p3.
Bài 2. Một nguyên tố có cấu hình electron nguyên tử như sau:
1s22s22p4; 1s22s22p3;
1s22s22p63s23p1; 1s22s22p63s23p5.
a) Hãy xác định số electron hóa trị của từng nguyên tố.
b) Hãy xác định vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải:
a) số electron hóa trị của từng nguyên tố:
+) 1s2 2s2 2p4: Có 6 electron hóa trị.
+) 1s2 2s2 2p3: Có 5 electron hóa tri
+) 1s2 2s2 2p6 3s2 3p1: Có 3 electron hóa trị
+) 1s2 2s2 2p6 3s2 3p5: Có 7 electron hóa trị
b) Ví trí (chu kỳ, nhóm) cửa các nguyên tố:
Dựa vào cấu hình electron của nguyên tử cho biết:
Số lớp electron suy ra số thứ tự của chu kì.
Các electron lớp ngoài cùng là electron s và electron p nên chúng đều là nguyên tố p, do vậy chúng thuộc nhóm A, vì thế số electron ngoài cùng cho biết số thứ tự của nhóm.
+) 1s2 2s2 2p4: Thuộc chu kì 2, nhóm VIA.
+) 1s2 2s2 2p3: Thuộc chu kì 2, nhóm VA.
+) 1s2 2s2 2p6 3s2 3p1: Thuộc chu kì , nhóm IIIA
+) 1s2 2s2 2p6 3s2 3p5: Thuộc chu kì 3, nhóm VIIA
Bài 3. Nguyên tử X, anion Y-, cation Z- đều có cấu hình electron ở lớp ngoài cùng là 4s24p6. Cho biết vị trí (chu kì, nhóm) và tính chất (phi kim hay kim loại) của X, Y, Z trong bảng hệ thống tuần hoàn.
Lời giải:
Từ cấu hình electron ở lớp ngoài cùng là 4s24p6 suy ra cấu hình electron đầy đủ là: ls22s22p63s23p63d104s24p6.
+) Nguyên tố X: ls22s22p63s23p63d104s24p6.
Thuộc chu kì 4, nhóm VIIIA; có 8e lớp ngoài cùng X là khí hiếm.
+) Nguyên tố Y: Từ Y + 1e = Y-
Nên cấu hình của Y là: ls22p22p63s23p63d104s24p6, thuộc chu kì 4, nhóm VIIA; có 7e lớp ngoài cùng ⇒ Y là phi kim.
+) Nguyên tố Z: Từ z = z+ + le
Nên cấu hình của z là: 1s22s22p63s23p63d104s24p65s1, thuộc chu kì 5, nhóm IA; có 1e lớp ngoài cùng z là kim loại.
Câu 4. Cation (ion dương) X+ có cấu hình electron ở phân lớp ngoài cùng là 2p6.
a) Viết cấu hình electron và sự phân bố electron theo obitan của nguyên tố X.
b) Cho biết vị trí của X.
Lời giải:
Đáp án:
a) Viết cấu hình electron và sự phân bố electron vào obitan.
Vì cation X+ là do nguyên tử X mất đi 1 electron nên cấu hình electron của X: 1s22s22p62s2 3s1 và sự phân bố các obitan như sau:
b) X thuộc chu kì 3 vì có 3 lớp electron.
X thuộc nhóm IA vì có 1 electron ở lớp ngoài cùng.
X thuộc ô 11 vì có tổng điện tích 11.
Bài 5. Xác định vị trí của nguyên tố có Z = 20 và nguyên tố có Z = 29.
Lời giải:
- Với nguyên tố có Z = 20 thì cấu hình electron: 1s22s22p63s23p64s2 trong bảng tuần hoàn nguyên tố đó ở
+) Ô thứ 20.
+) Chu kì 4: vì có 4 lớp electron.
+) Nhóm IIA vì có 2 electron cuối cùng chiếm obitan 4s2 ở lớp ngoài cùng.
- Với nguyên tố có Z = 29 thì cấu hình electron: 1s22s22p63s23p63d104s1 trong bảng tuần hoàn nguyên tố đó ở.
+) Ô thứ 29.
+) Chu kì 4 vì có 4 lớp electron.
+) Nhóm IB vì có electron ứng với mức năng lượng cao nhất chiếm obitan 3d; tổng số electron ở (n - l)d và ns là 11 nên thuộc nhóm 11 - 10 = 1.
Xem thêm các dạng bài tập Hóa Học hay khác:
Cách xác đinh số electron lớp ngoài cùng (2024) hay nhất, chi tiết nhất
Cách tính phần trăm số nguyên tử mỗi đồng vị (2024) hay nhất, chi tiết nhất
Cách tính khối lượng nguyên tử (2024) hay nhất, chi tiết nhất
Cách tính độ pH (2024) hay, chi tiết nhất
Cách tính nguyên tử khối trung bình (2024) chi tiết, có đáp án