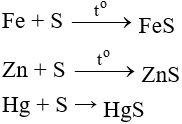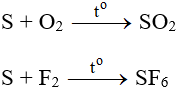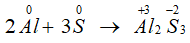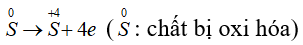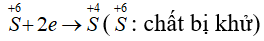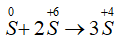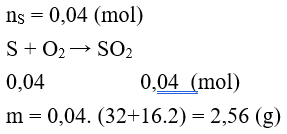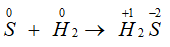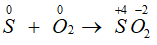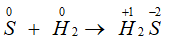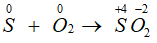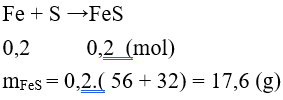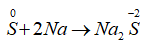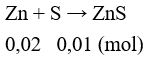Bài tập về Lưu huỳnh và hợp chất chứa lưu huỳnh
1. Lí thuyết và phương pháp giải
1.1 Tính chất vật lí, hóa học của lưu huỳnh
Tính chất vật lí
- Hai dạng thù hình của lưu huỳnh
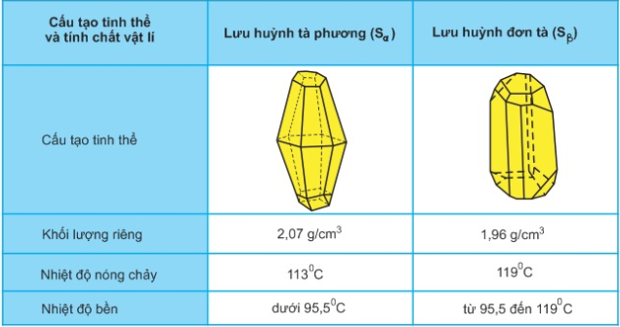
Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau.
Chúng biến đổi qua lại với nhau theo nhiệt độ.
- Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí của lưu huỳnh
+ to < 113oC, Sα và Sβ là chất rắng, màu vàng. Phân tử gồm 8 nguyên tử liên kết cộng hóa trị với nhau thành mạch vòng.
+ to = 119oC, S nóng chảy thành chất lòng màu vàng, linh động. S8 mạch vòng.
+ to = 187oC, S lỏng → quánh nhớt màu nâu đỏ.
+ to = 445oC, S sôi → Sn bị đứt gãy thành nhiều phân tử nhỏ bay hơi.
Ở 1700oC hơi lưu huỳnh là những nguyên tử S.
Tính chất hóa học
Tác dụng với kim loại và hidro
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro:
H2 + S → H2S (350oC)
- Tác dụng với kim loại (có to, tạo sản phẩm có số oxh thấp của kim loại).
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, ...
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, ...
Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
- Tác dụng với oxi:
- Tác dụng với các chất có tính oxi hóa mạnh:
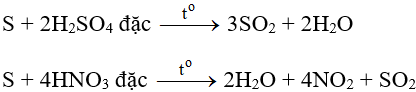 1.2 Kiến thức mở rộng
1.2 Kiến thức mở rộng
Ứng dụng
S là nguyên liệu quan trọng cho nhiều ngành công nghiệp.
- Điều chế H2SO4.
- Dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm, ...
Điều chế
- Đốt H2S trong điều kiện thiếu không khí.
2H2S + O2 → 2S + 2H2O
- Dùng H2S để khử SO2.
2H2S + SO2 → 3S + 2H2O
Phương pháp này giúp thu hồi trên 90% lượng S có trong các khí thải độc hại SO2 và H2S.
1.3 Phương pháp giải
Dạng bài tập thường gặp liên quan đến lưu huỳnh là dạng bài lưu huỳnh phản ứng với kim loại. – Để làm tốt dạng bài tập này ngoài việc thành thạo các dạng bài: chất dư chất hết, hỗn hợp chất, tính theo phương trình phản ứng, … học sinh cần lưu ý:
– Cần dựa vào các dữ kiện đề bài cho để xác định thành phần của hỗn hợp rắn sau phản ứng. Ví dụ khi cho hỗn hợp rắn phản ứng với dung dịch axit thông thường (HCl, …) nếu tạo khí H2H2 chứng tỏ trong hỗn hợp rắn có kim loại còn dư.
– Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS…
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S…
– Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen) → thường được dùng để nhận biết gốc sunfua.
2. Ví dụ minh họa
Ví dụ 1: Vị trí của nguyên tố lưu huỳnh (z = 16) trong bảng tuần hoàn hóa học là
A. Ô thứ 16, chu kì 3, nhóm VIA.
B. Ô thứ 16, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm IVA.
D. Ô thứ 16, chu kì 2, nhóm IVA.
Lời giải:
Đáp án A.
Cấu hình electron của lưu huỳnh: 1s22s22p63s23p4
Lưu huỳnh thuộc ô thứ 16 (do z = 16), chu kỳ 3 (do có 3 lớp electron), nhóm VIA (do có 6e lớp ngoài cùng, nguyên tố p).
Ví dụ 2: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na. B. Cl.
C. O. D. S.
Lời giải:
Đáp án D.
Cấu hình của X: 1s22s22p63s23p4.
→ X thuộc ô 16, chu kỳ 3, nhóm VIA. X là lưu huỳnh (S).
Ví dụ 3: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
A. 0, 2, 4, 6. B. -2, 0, +4, +6.
C. 1, 3, 5, 7. D. -2, +4, +6.
Lời giải:
Đáp án D.
Ở trạng thái cơ bản S có 2 electron độc thân, ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Do đó trong hợp chất S có thể thể hiện các số oxi hóa -2, +4, +6.
3. Bài tập vận dụng
Câu 1: Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với chất nào dưới đây?
A. O2. B. Al.
C. H2SO4 đặc. D. F2.
Lời giải:
Đáp án B.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Câu 2: Cho phản ứng: S + 2H2SO4(đặc) → 3SO2↑ + 2H2O. Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là
A. 1 : 2. B. 1 : 3.
C. 3 : 1. D. 2 : 1.
Lời giải:
Đáp án D.
Quá trình khử:
Quá trình oxi hóa:
PTSC:
→ Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là 2 : 1.
Câu 3: Có bao nhiêu gam SO2 hình thành khi cho 1,28 gam S phản ứng hoàn toàn với lượng O2 dư?
A. 2,28 g B. 2,00 g
C. 1,00 g D. 2,56 g
Lời giải:
Đáp án D.
Câu 4: Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2. B. O3.
C. S. D. O2.
Lời giải:
Đáp án C.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Câu 5: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
A. Lưu huỳnh không có tính oxi hoá, tính khử.
B. Lưu huỳnh chỉ có tính oxi hoá.
C. Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử.
D. Lưu huỳnh chỉ có tính khử.
Lời giải:
Đáp án C
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Câu 6: Dãy gồm các chất đều tác dụng trực tiếp với lưu huỳnh là
A. Hg, O2, HCl.
B. Pt, Cl2, HCl.
C. Zn, O2, F2.
D. Na, Br2, H2SO4 loãng.
Lời giải:
Đáp án C
Zn + S 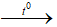
S + O2 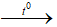
S + 3F2 → SF6
Câu 7: Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường?
A. Al. B. Fe.
C. Hg. D. Cu.
Lời giải:
Đáp án C.
Hg + S → HgS
Câu 8: Nhận định nào sau đây là sai?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với O2, Cl2, F2 thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Lời giải:
Đáp án C
S thể hiện tính khử khi tác dụng với O2, Cl2, F2.
Câu 9: Đun nóng 11,2 gam Fe trong lưu huỳnh dư, khối lượng muối thu được sau phản ứng là
A. 8,8g. B. 17,6g.
C. 4,4g. D. 35,2 g.
Lời giải:
Đáp án B
Câu 10: Cho phản ứng hóa học: S + H2SO4đặc 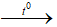
A. SO2. B. H2S.
C. H2SO3. D. SO3.
Lời giải:
Đáp án A
S + 2H2SO4 → 3SO2↑ + 2H2O
Câu 11: Nhận định nào sau về lưu huỳnh là sai?
A. S là chất rắn màu vàng.
B. S không tan trong nước.
C. S dẫn điện, dẫn nhiệt kém.
D. S không tan trong các dung môi hữu cơ.
Lời giải:
Đáp án A
S tan tốt trong dung môi hữu cơ.
Câu 12: Nung 6,5 gam Zn với bột lưu huỳnh. Khối lượng lưu huỳnh cần dùng để phản ứng hết với lượng kẽm là
A. 3,2 B. 1,6
C. 6,4 D. 4
Lời giải:
Đáp án A
Câu 13: Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hóa?
A. S + O2 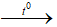
B. S + 2Na 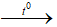
C. S + 2H2SO4(đ) 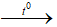
D. S + 6HNO3(đ) 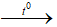
Lời giải:
Đáp án B
Câu 14: Cho các phản ứng sau:
(a) S + O2 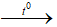
(b) S + 3F2 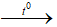
(c) S + 6HNO3 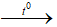
(d) S + Hg → HgS
Số phản ứng trong đó S thể hiện tính khử là
A. 2. B. 3.
C. 1. D. 4.
Lời giải:
Đáp án B
Các phương trình a, b, c.
Câu 15: Cho 1,3 gam kẽm tác dụng với 0,32 gam lưu huỳnh. Sau khi phản ứng xảy ra hoàn toàn, sản phẩm thu được là
A. ZnS. B. ZnS và S.
C. ZnS và Zn. D. ZnS, Zn và S.
Lời giải:
Đáp án C
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.
Xem thêm các dạng Bài tập Hóa học hay khác:
40 Bài tập về kim loại kiềm (2024) có đáp án
40 Bài tập kim loại tác dụng với HNO3 (2024) có đáp án
30 Bài tập công thức tính hiệu suất phản ứng (2024) có đáp án