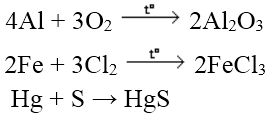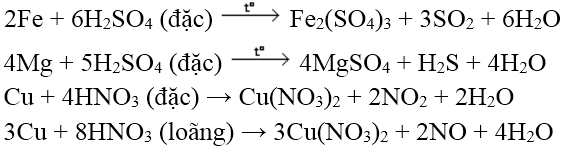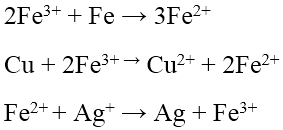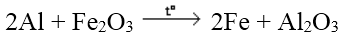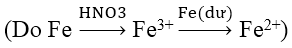Bài tập về kim loại
1. Lí thuyết và phương pháp giải
1.1 Tính chất vật lí và hóa học của kim loại
- Tính chất vật lí
Kim loại có tính chất vật lí chung là dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
Một số tính chất vật lí riêng:
* Tỉ khối: của các kim loại rất khác nhau nhưng thường dao động từ 0,5 (Li) đến 22,6 (Os). Thường thì:
+ d < 5: kim loại nhẹ (K, Na, Mg, Al).
+ d > 5: kim loại nặng (Zn, Fe...).
* Nhiệt độ nóng chảy: biến đổi từ -39oC (Hg) đến 3410oC (W). Thường thì:
+ t < 10000C: kim loại dễ nóng chảy.
+ t > 15000C: kim loại khó nóng chảy (kim loại chịu nhiệt).
* Tính cứng: Biến đổi từ mềm đến rất cứng.
Tỷ khối, nhiệt độ nóng chảy và tính cứng của kim loại phụ thuộc vào nhiều yếu tố như kiểu mạng tinh thể; mật độ e; khối lượng mol của kim loại...
- Tính chất hóa học
Tính chất đặc trưng của kim loại là tính khử (nguyên tử kim loại dễ bị oxi hóa thành ion dương): M → Mn+ + ne
Tác dụng với phi kim
Hầu hết các kim loại khử được phi kim điển hình thành ion âm
Ví dụ:
Tác dụng với axit
Đối với dung dịch HCl, H2SO4 loãng:
M + nH+ → Mn+ + n/2H2
(M đứng trước hiđro trong dãy thế điện cực chuẩn)Đối với H2SO4 đặc, HNO3 (axit có tính oxi hóa mạnh):
+ Kim loại thể hiện nhiều số oxi hóa khác nhau khi phản ứng với H2SO4 đặc, HNO3 sẽ đạt số oxi hóa cao nhất.
+ Hầu hết các kim loại phản ứng được với HNO3 và H2SO4 đặc (trừ Pt, Au)
Lưu ý: Fe, Al, Cr bị thụ động hóa trong H2SO4 và HNO3 đặc nguội.
Khi đó S
+6 H2SO4 bị khử thành S+4 (SO2); So hoặc S-2 (H2S)
Trong HNO3 đặc N+5 bị khử thành N+4 (NO2)
Với HNO3 loãng N+5 bị khử thành N+2(NO); N+1 (N2O); No (N2); N-3 (NH4+)
+ Các kim loại có tính khử càng mạnh thường cho sản phẩm khử có số oxi hóa càng thấp. Các kim loại như Na, K... sẽ gây nổ khi tiếp xúc với các dung dịch axit
Ví dụ:
Tác dụng với dung dịch muối
Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
Với các kim loại không tan trong nước, kim loại hoạt động đẩy được kim loại kém hoạt động ra khỏi dung dịch muối của chúng theo quy tắc α.
Fe + CuSO4 → FeSO4 + Cu
Chú ý:
Tác dụng với dung dịch kiềm
Các kim loại mà hiđroxit của chúng có tính lưỡng tính như Al, Zn, Be, Sn, Pb... tác dụng được với dung dịch kiềm (đặc).
2Al + 6H2O + 2NaOH → 2Na[Al(OH)4] + 3H2
Tác dụng với oxit kim loại
Các kim loại mạnh khử được các oxit kim loại yếu hơn ở nhiệt độ cao thành kim loại
Ví dụ:
1.2 Phương pháp giải
Bước 1: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
– Công thức bảo toàn electron:
∑enhường = ∑enhận
– Công thức bảo toàn nguyên tố: Giả sử ta có hợp chất AxBy
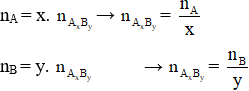
Chú ý:
Bước 2: Tính nguyên tử khối theo công thức M=mn (g/mol), từ đó suy ra tên kim loại
2. Ví dụ minh họa
Ví dụ 1: Hòa tan hết 4,68 gam kim loại kiềm M vào nước dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb
B. Li
C. K
D. Na
Đáp án: C. K
nH2=1,34422,4=0,06 mol
Phương trình hóa học:
2M+2H2O→2MOH+H2
Theo phương trình:
nM=2nH2=2.0
(g/mol)
Vậy M là kim loại kali (K)
Ví dụ 2: Cho 4,017 gam một kim loại kiềm X hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là
A. Na
B. Li
C. Rb
D. K
Đáp án: D. K
Phương trình hóa học:
2X + 2H2O 2XOH + H2(1)
XOH + HCl XCl + H2O (2)
Theo phương trình (2): nXOH = nHCl = 0,103 mol
Theo phương trình (1): nX = nXOH = 0,103 mol
(g/mol)
Vậy X là kim loại kali (K)
3. Bài tập vận dụng
Bài 1: A là hỗn hợp hai kim loại kiềm X và Y thuộc hai chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam hai muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam hai muối. X và Y là
A. Li và Na
B. Na và K
C. K và Rb
D. Rb và Cs
Đáp án: B. Na và K
Đặt công thức chung của hai kim loại kiềm là R, khối lượng mol trung bình của chúng là
Chọn số mol của R tham gia phản ứng là 1 mol
Phương trình phản ứng:
2R + 2HCl 2RCl + H2 (1)
2R + H2SO4 R2SO4 + H2 (2)
Theo phương trình (1):
(3)
Theo phương trình (2):
(4)
Từ (3) và (4) ta có
Nhận xét:
X và Y là Na và K
Bài 2: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là
A. Li, Na
B. Na, K
C. K, Rb
D. Rb, Cs
Đáp án: B. Na, K
Đặt công thức chung của A và B là M
Phương trình phản ứng:
2M + 2H2O 2MOH + H2(1)
Theo phương trình:
Vậy hai kim loại là Na và K
Bài 3: Hòa tan hết 0,897 gam kim loại X vào 4,459 ml nước tạo ra dung dịch kiềm có nồng độ 29,34%. Biết khối lượng riêng của nước là 1 g/ml. Kim loại X là
A. Na
B. Ba
C. K
D. Ca
Đáp án: A. Na
Bài 4: Một dung dịch có chứa các ion: x mol M3+, 0,2 mol Mg2+, 0,3 mol Cu2+, 0,6 mol SO42-, 0,4 mol NO3-. Cô cạn dung dịch này thu được 116,8 gam hỗn hợp các muối khan. M là:
A. Cr
B. Fe
C. Al
D. Zn
Đáp án: A. Cr
Áp dụng định luật bảo toàn điện tích, ta có:
3x + 0,2.2 + 0,3.2 = 0,6.2 + 0,4 ⇒ x = 0,2 mol
Ta có: mmuối = mM3+ + mMg2+ + mCu2+ + mSO42- + mNO3-
116,8 = 0,2.MM + 0,2.44 + 0,3.64 + 0,6.96 + 0,4.62
MM = 52 ⇒ M là Cr.
Bài 5: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
A. 1M
B. 0,5M
C. 0,25M
D. 0,4M
Đáp án: B. 0,5M
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy nCuSO4 phản ứng = 0,8/8 = 0,1(mol) và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 6: Oxi hóa hoàn toàn 0,792 gam hỗn hợp bột Fe và Cu ta thu được 1,032 gam hỗn hợp các oxit (hỗn hợp X). Hãy tính thể tích khí H2 (đktc) tối thiểu cần để khử hoàn toàn các oxit thành kim loại.
A. 1,12l
B. 0,48l
C. 0,336l
D. 0,24l
Đáp án: C. 0,336l
Áp dụng định luật bảo toàn khối lượng ta có:
nCO2 = (1,032 - 0,792)/32 = 0,0075(mol)
Do lượng kim loại không thay đổi nên số mol electron do O2 nhận vào bằng số mol electron do H2 mất.
⇒ nH2 = 2nO2 = 0,015 ⇒ VH2 = 0,336 (lít)
Bài 7: Hòa tan hết 7,74 g hỗn hợp bột M, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít H2 (ở đktc). Cô cạn dung dịch X thu được lượng muối khan là:
A. 38,93 gam
B. 103,85 gam
C. 25,95 gam
D. 77,86 gam
Đáp án: A. 38,93 gam
Ta có: nH2 = 8,736/22,4 = 0,39 mol
nHCl = 0,5.1 = 0,5 mol
nH2SO4 = 0,28.0,5 = 0,14 mol
Áp dụng định luật bảo toàn khối lượng:
mhh + mHCl + mH2SO4 = mmuối + mH2
mmuối = 7,74 + 0,5.36,5 + 0,14.98 - 039.2 = 38,93 gam.
Bài 8: Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7:3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là:
A. 448
B. 40,5
C. 33,6
D. 50,4
Đáp án: D. 50,4
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có: nHNO3 = 0,7; nNO + nNO2 = 0,25 mol; số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
Áp dụng ĐLBT nguyên tố N ta có:
0,7 = 2. 0,25m/56 + 0,25 → m = 50,4 (g)
Xem thêm các dạng bài tập Hóa học hay khác:
20 Bài tập về phản ứng thủy phân xenlulozo (2024) có đáp án
30 Bài tập về nước cứng (2024) có đáp án chi tiết nhất
30 Bài tập về este đơn chức (2024) có đáp án chi tiết nhất
30 Bài tập về NH3 (2024) có đáp án chi tiết nhất
30 Bài tập về thủy phân Saccarozo (2024) có đáp án