Bài tập về phân loại muối
1. Lí thuyết và phương pháp giải
1.1 Phân loại muối
Muối gồm có năm loại:
+ Muối axit: Muối có anion gốc axit còn khả năng phân li cho ion H+.
Ví dụ: NaHCO3; NaH2PO4; NaHSO4; ...
+ Muối trung hoà: Muối có anion gốc axit không còn khả năng phân li cho ion H+.
Ví dụ: NaCl , (NH4)2SO4, Na2CO3, ...
+ Muối bazo: Muối có nhóm –OH có thể thay thế bằng gốc axit.
Ví dụ: Mg(OH)Cl; Fe(OH)2Cl, ...
+ Ngoài ra còn kể đến một số muối kép như: HCl.NaCl; KCl.MgCl.6H2O; K2SO4.Al2(SO4)3, ...
+ Muối phức: [Ag(NH3)2]Cl; [Cu(NH3)4]SO4, ...
1.2 Phương pháp giải
Bước 1: Tính các số mol của các chất mà đề bài cho dữ kiện (hoặc đặt ẩn tùy theo từng bài).
Bước 2. Viết các phương trình hoá học xảy ra.
Bước 3. Xác định chất dư (nếu có) và tính toán theo yêu cầu của đề bài.
Ngoài ra có thể phối hợp áp dụng định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố, ... để giải quyết bài toán.
- Một số phản ứng giữa hai muối nhưng không là phản ứng trao đổi, cần lưu ý:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2 ↑
2. Ví dụ minh họa
Ví dụ 1: Dãy gồm các muối tác dụng với dung dịch BaCl2 là
A. Na2CO3, Na2SO3, NaCl
B. Na2SO4; K2CO3; AgNO3
C. CaCO3, Na2CO3, MgCl2
D. AgNO3, Na2CO3, Cu(NO3)2
Đáp án: B. Na2SO4; K2CO3; AgNO3
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
BaCl2 + K2CO3 → BaCO3 ↓ + 2KCl
BaCl2 + 2AgNO3 → 2AgCl ↓ + Ba(NO3)2.
Ví dụ 2: Cho 20ml dung dịch NaCl 1M vào lượng dư dung dịch AgNO3. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
A. 28,7 gam.
B. 2,87 gam
C. 27,8 gam
D. 2,78 gam
Đáp án: B. 2,87 gam
Ta có: nNaCl = 0,02.1 = 0,02 mol
Phương trình phản ứng:
NaCl + AgNO3 → NaNO3 +AgCl ↓
0,02 …………………………0,02 (mol)
Khối lượng kết tủa tạo thành:
mAgCl = 0,02.(108 + 35,5) = 2,87 (g)
Ví dụ 3: Cho 400ml dung dịch K2CO3 0,1M vào 200ml dung dịch BaCl2 0,1M đến khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 3,94 gam
B. 3,49 gam
C. 7,88 gam
D. 11,70 gam
Đáp án: A. 3,94 gam
nBaCl2 = 0,02 mol
nK2CO3 = 0,04 mol
Phương trình phản ứng:
K2CO3 + BaCl2 → 2KCl + BaCO3 ↓
0,04 0,02 mol
- Xét tỉ lệ:
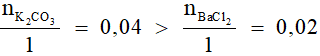
Vậy BaCl2 hết, số mol kết tủa tính theo BaCl2.
Từ PTHH có:
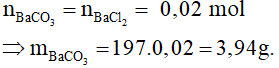
3. Bài tập vận dụng
Bài 1: Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
A. 100 g
B. 143,5 g
C. 143,3 g
D. 134,5 g
Đáp án: B. 143,5 g
Ta có: nNaCl = 2.0,5 = 1 mol
nAgNO3= 2.0,6 = 1,2 mol
Phương trình phản ứng hóa học:
NaCl + AgNO3 → NaNO3 + AgCl↓
mol 1 1,2
Ta có : 11<1,21⇒NaCl hết, AgNO3 dư
⇒n↓= nAgCl = nNaCl = 1 mol
⇒m↓= 1.143,5 = 143,5 g
Bài 2: Cho 0,1 mol FeCl3 tác dụng hết với dung dịch Na2CO3 dư, thu được chất khí B và kết tủa C. Đem nung C đến khối lượng không đổi thu được chất rắn D. Tính thể tích khí B (đktc) và khối lượng chất rắn D.
A. 18 g
B. 8 g
C. 28 g
D. 10 g
Đáp án: B. 8 g
2FeCl3 + 3H2O + 3Na2CO3 → 2Fe(OH)3 + 3CO2 + 6NaCl
0,1 0,1 0,15 mol
⇒Chất khí B là CO2, kết tủa C là Fe(OH)3
⇒VCO2= 0,15.22,4 = 3,36 lít
2Fe(OH)3 to→ Fe2O3 + 3H2O
0,1 0,05
⇒Chất rắn D là Fe2O3
⇒mD = 0,05.160 = 8 g
Bài 3: Cho Na2CO3 vào từng dung dịch sau: NaCl, BaCl2, Ba(NO3)2, Ca(NO3)2. Số phản ứng xảy ra là
A. 1
B. 2
C. 3
D. 4
Đáp án C. 3
Na2CO3 + NaCl → không phản ứng.
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3.
Bài 4: Cho 20ml dung dịch AgNO3 1M vào lượng dư dung dịch KCl. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
A. 28,7 gam
B. 2,87 gam
C. 27,8 gam
D. 2,78 gam
Đáp án: B. 2,87 gam
Ta có: nAgNO3= 0,02.1 = 0,02 mol
Phương trình phản ứng:
AgNO3 + KCl → KNO3 +AgCl ↓
0,02 ………………………….0,02 (mol)
Khối lượng kết tủa tạo thành: mAgCl = 0,02.(108 + 35,5) = 2,87 (g)
Bài 5: Biết 200g dung dịch Na2CO3 10,6% tác dụng vừa đủ với 200 ml dung dịch Ca(NO3)2. Nồng độ dung dịch Ca(NO3)2 đã dùng là
A. 1M
B. 2M
C. 0,1M
D. 0,2M
Đáp án: A. 1M
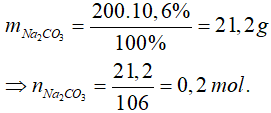
Phương trình hoá học:
Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
0,2................0,2 mol
Nồng độ dung dịch Ca(NO3)2 đã dùng là:
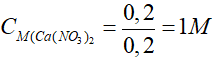
Bài 6: Cho 26,1 gam K2SO4 vào dung dịch chứa 20,8 gam BaCl2, sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 23,3
B. 2,33
C. 34,95
D.3,495
Đáp án: A. 23,3
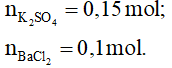
Phương trình hóa học:
K2SO4 + BaCl2 → BaSO4↓ + 2KCl
0,15 0,1 mol
Có
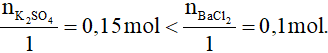
Vậy sau phản ứng BaCl2 hết; số mol kết tủa tính theo BaCl2.
Bài 7: Cho 500ml dung dịch NaCl 0,2M tác dụng với 600ml dung dịch AgNO3 0,2M. Đến khi phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được sau phản ứng là
A. 143,5 gam
B. 134,5 gam
C. 14,35 gam
D. 13,45 gam
Đáp án: C. 14,35 gam
nNaCl = 0,5.0,2 = 0,1 mol; nAgNO3= 0,6.0,2 = 0,12 mol
Phương trình hóa học:
NaCl + AgNO3 → AgCl↓ + NaNO3
Xét tỷ lệ
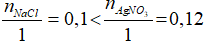
Vậy NaCl phản ứng hết, AgNO3 còn dư.
Ta có: nAgCl = nNaCl = 0,1 mol → mAgCl = 14,35 gam.
Bài 8: Cho 35,4 gam hỗn hợp gồm 2 muối Na2SO4 và Na2CO3 tác dụng hoàn toàn với dung dịch BaCl2 sau phản ứng thu được 62,7 gam kết tủa. Khối lượng mỗi muối trong hỗn hợp ban đầu là
A. 24,2 gam và 11,2 gam
B. 12,4 gam và 22,1 gam
C. 20,2 gam và 15,2 gam
D. 14,2 gam và 21,2 gam
Đáp án: D. 14,2 gam và 21,2 gam
Gọi x và y lần lượt là số mol của Na2SO4 và Na2CO3 trong hỗn hợp ban đầu.
Ta có: 142x + 106y = 35,4 (1)
Phương trình hóa học:
Na2SO4 + BaCl2→ BaSO4 + 2NaCl
x mol …………. x mol
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
y mol…………… y mol
Tổng khối lượng kết tủa là 233x + 197y = 62,7 (2)
Từ (1) và (2) được x = 0,1 mol và y = 0,2 mol
Khối lượng Na2SO4 là 0,1.142= 14,2 gam
Khối lượng Na2CO3 là 0,2.106= 21,2 gam
Bài 9: Cho 500ml dung dịch A gồm BaCl2 và MgCl2 phản ứng với 120ml dung dịch Na2SO4 0,5M, đến khi phản ứng xảy ra hoàn toàn thu được 11,65g kết tủa. Lọc bỏ kết tủa đem phần dung dịch cô cạn thu được 16,77g hỗn hợp muối khan. Nồng độ mol/l các chất trong dung dịch A là
A. 0,1M và 0,2M
B. 0,01M và 0,02M
C. 0,5M và 0,1M
D. 0,05M và 0,02M
Đáp án: A. 0,1M và 0,2M
Cho hỗn hợp A phản ứng với BaCl2 chỉ có Na2SO4 phản ứng.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,05 ← 0,05 ← 0,05 → 0,1 mol
Số mol Na2SO4 còn dư là 0,06 – 0,05 = 0,01 mol
Số mol MgCl2
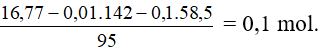
Vậy trong 500ml dd A có 0,05 mol BaCl2 và 0,1 mol MgCl2.
→ Nồng độ của BaCl2 = 0,05/0,5 = 0,1M và nồng độ của MgCl2 =0,1/0,5 = 0,2M.
Bài 10: Trộn 10g dung dịch AgNO3 34% với 10g dung dịch Fe(NO3)2 18% đến khi phản ứng hoàn toàn thấy thu được m gam Ag. Giá trị của m là
A. 5,4 gam
B. 10,8 gam
C. 0,54 gam
D. 1,08 gam
Đáp án: D. 1,08 gam
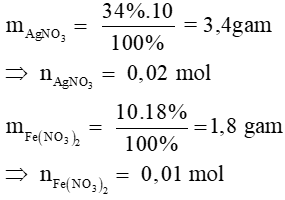
Phương trình phản ứng:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 +Ag (1)
Ta có:
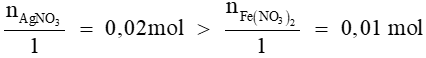
Vậy AgNO3 dư, Fe(NO3)2 hết
Từ (1) có nAg = = 0,01 mol
→ mAg = 0,01.108 = 1,08gam.
Xem thêm các dạng bài tập Hóa học hay khác:
40 Bài tập về kim loại (2024) có đáp án
20 Bài tập về phản ứng thủy phân xenlulozo (2024) có đáp án
20 Bài tập về phản ứng thủy phân tinh bột (2024) có đáp án




