Bài tập về Nhận biết một số chất vô cơ
I. Lý thuyết và phương pháp giải
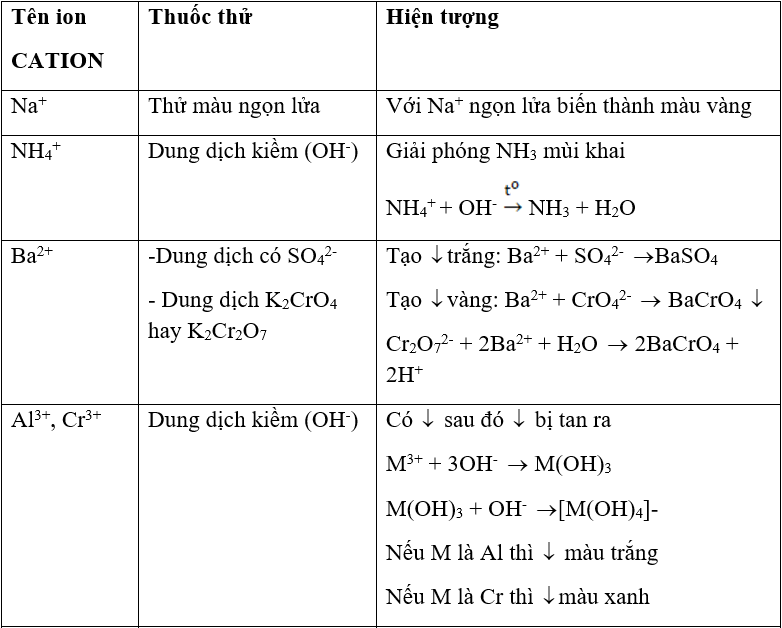
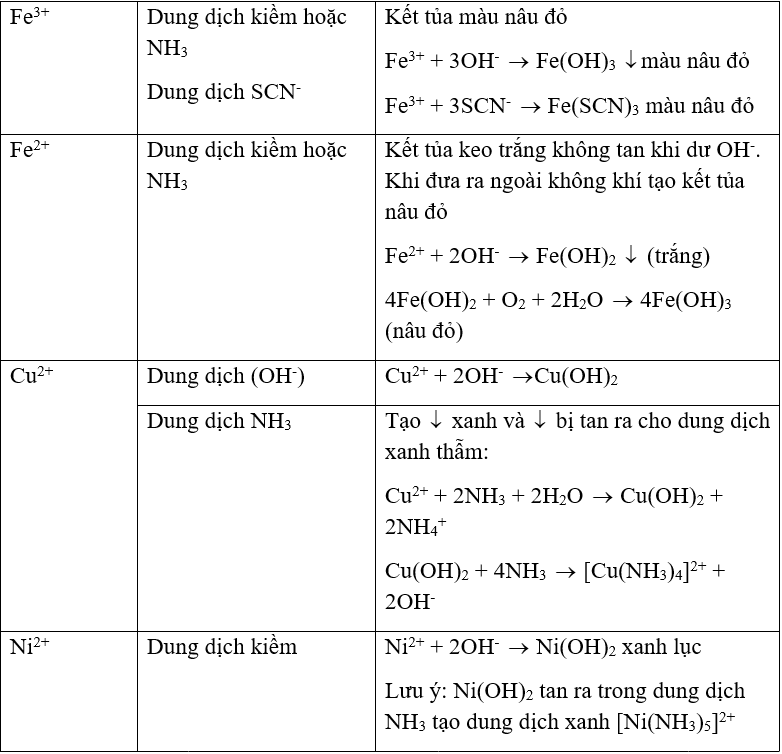
- Nhận biết cation
BẢNG TỔNG HỢP NHẬN BIẾT CATION
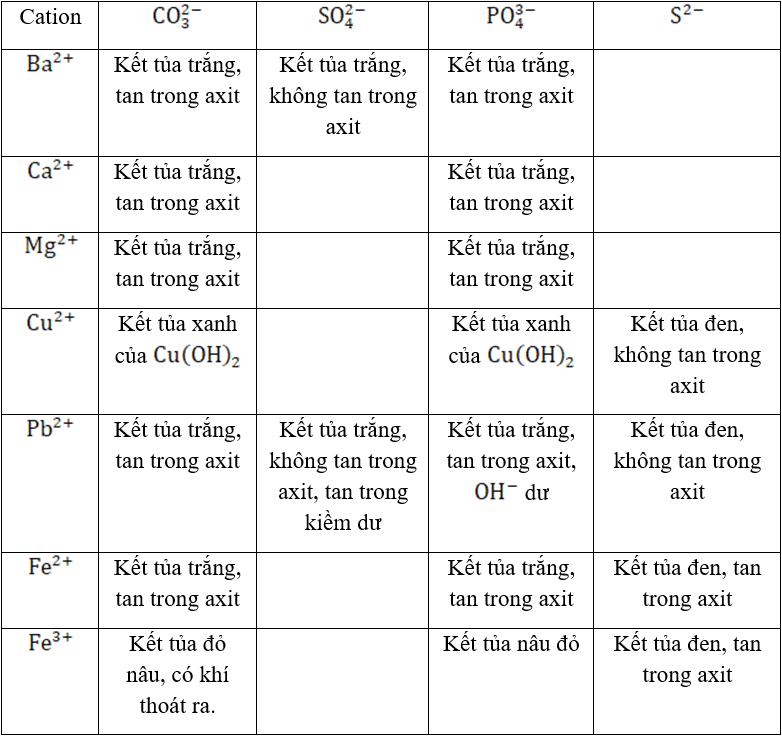
BẢNG NHẬN BIẾT CATION TẠO KẾT TỦA VỚI HALOGENUA
BẢNG NHẬN BIẾT CATION TẠO KẾT TỦA CACBONAT, PHOTPHAT, SUNFUA
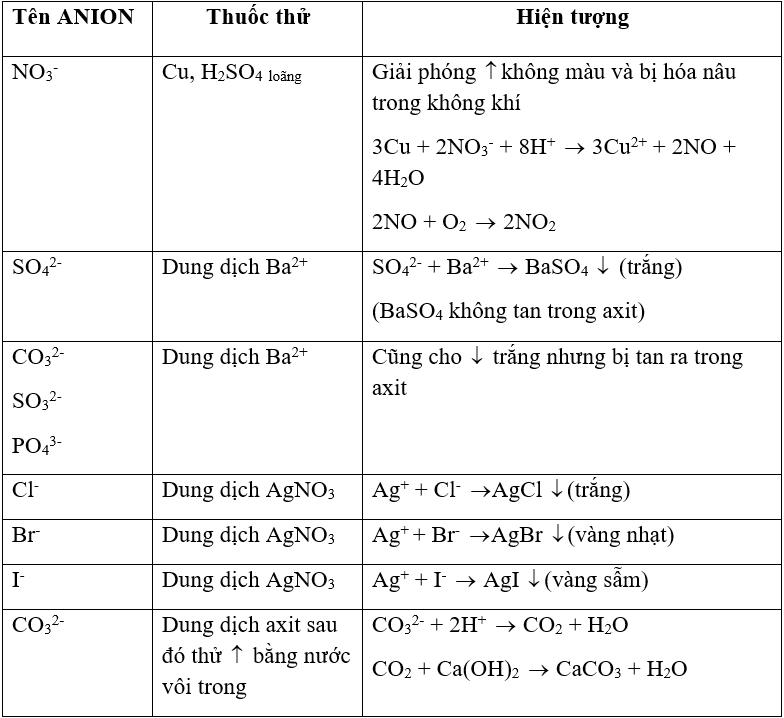
- Nhận biết anion
BẢNG TỔNG HỢP NHẬN BIẾT ANION
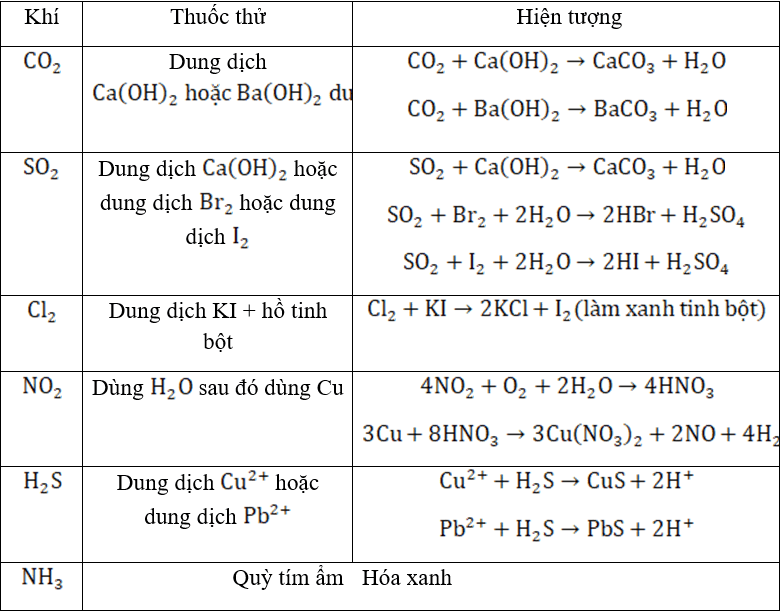
- Nhận biết một số chất khí
BẢNG TỔNG HỢP NHẬN BIẾT CHẤT KHÍ
II. Ví dụ minh họa
Ví dụ 1: Cần thêm bao nhiêu ml dung dịch NaOH 0,25M vào 50ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2 ?
A. 35,5ml B. 36,5ml
C. 37,5ml D.38,5ml
Đáp án: B
VNaOH = V; nH+ = nHCl + 2nH2SO4 = 0,005 + 0,005 = 0,01 mol
H+ + OH- → H2O
pH = 2 ⇒ [H+] dư = 0,01
⇒ V = 0,0365 lít = 36,5ml
Ví dụ 2: Chuẩn độ 20ml dung dịch hỗn hợp HCl 0,1M + HNO3 aM cần dùng 16,5ml dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Gía trị của a là?
A.0,07 B. 0,08
C.0,065 D.0,068
Đáp án: C
nH+ = 0,002 + 0,02a
nOH- = 0,0033 mol
Ta có: nH+ = nOH-
⇒ a = 0,065
Ví dụ 3: Khí CO2 có lẫn tạp chất là khí HCl. Để loại tạp chất HCl đó nên cho khí CO2 đi qua dung dịch nào sau đây là tốt nhất?
A. Dung dịch NaOH dư
B. Dung dịch Na2CO3 dư
C. Dung dịch NaHCO3 dư
D. Dung dịch AgNO3 dư
Đáp án: C
Vì NaHCO3 vừa loại được HCl lại tạo ra được một lượng CO2 mới.
NaHCO3 + HCl → NaCl + CO2 + H2O
III. Bài tập vận dụng
Bài 1: Để tách riêng các ion Fe3+, Al3+, Cu2+ ra khỏi hỗn hợp thì có thể dùng các hóa chất nào sau đây?
A. Các dung dịch KOH, NH3, H2SO4
B. Các dung dịch NH3, H2SO4, HCl
C. Các dung dịch H2SO4, KOH, BaCl2
D. Các dung dịch H2SO4, NH3, HNO3
Đáp án: A
Bài 2: Có 3 khí SO2; CO2; H2S. Chỉ dùng một hóa chất nào sau đây để phân biệt được cả 3 khí trên?
A. Dung dịch Ca(OH)2
B. Dung dịch Ba(OH)2
C. Dung dịch Br2
C. Dung dịch HCl
Đáp án: C
SO2 + Br2 + 2H2O → HBr (Không màu) + H2SO4
H2S + Br2 → 2HBr + S↓ vàng
Bài 3: Để phân biệt các dung dịch riêng biệt : CuSO4, FeCl3, Al2(SO4)3, K2CO3, (NH4H2SO4, NH4NO3, người ta có thể dùng thuốc thử nào sau đây ?
A. Kim loại K B. Kim loại Ba
C. Dung dịch NaOH D. Dung dịch BaCl2
Đáp án: B
Bài 4: Muối ăn bị lẫn các tạp chất là Na2SO4, MgCl2, CaCl2 và CaSO4, để thu được NaCl tinh khiết, người ta lần lượt dùng các dung dịch
A. NaOH dư, Na2CO3 dư, H2SO4 dư, rồi cô cạn.
B. BaCl2 dư, Na2CO3 dư, HCl dư, rồi cô cạn.
C. Na2CO3 dư, HCl dư, BaCl2 dư, rồi cô cạn.
D. Ba(OH)2 dư, Na2SO4 dư, HCl dư, rồi cô cạn.
Đáp án: B
Bước 1. Dùng dung dịch BaCl2
Ba2+ + SO42- → BaSO4
Lọc kết tủa được dung dịch gồm: Na+, Mg2+, Ca2+, Ba2+, Cl-
Bước 2. Thêm dung dịch Na2CO3 dư
R2+ + CO32- → RCO3
(R2+ là Mg2+. Ba2+, Ca2+)
Lọc kết tủa thu được dung dịch gồm: Na+, CO32-, Cl-
Bước 3. Dùng dung dịch HCl
CO32- + 2H+ → CO2 + H2O
Cô cạn dung dịch thu được NaCl
Bài 5: Có 3 lọ không ghi nhãn, mỗi lọ đựng một trong các dung dịch (có cùng nồng độ) KCl, KBr, KI. Hai thuốc thử có thể dùng đề xác định dung dịch chứa trong mỗi lọ là:
A. khí O2 và dung dịch NaOH.
B. khí Cl2 và hồ tính bột.
C. brom long và benzen.
D. tính bột và brom lỏng.
Đáp án: B
Bài 6: Chuẩn độ 20ml dung dịch HCl aM bằng dung dịch NaOH 0,5M cần dùng hết 11ml. Gía trị của a là:
A. 0,275 B.0,55
C. 0,11 D. 0,265
Đáp án: A
nH+ = nOH- = 0,5. 0,011 = 0,055 mol
⇒ a = 0,055:0,02 = 0,275M
Bài 7: Chuẩn độ CH3COOH bằng dung dịch NaOH 0,1M. Kết quả thu được bảng sau đây:
|
Lần 1 |
Lần 2 |
Lần 3 |
|
|
VCH3COOH (ml) |
10 |
10 |
10 |
|
VNaOH (ml) |
12,4 |
12,2 |
12,6 |
Vậy khối lượng CH3COOH có trong 1 lít dung dịch là:
A. 7,44 B. 6,6
C. 5,4 D. 6,0
Đáp án: A
VNaOH = (12,4 + 12,2 + 12,6)/3 = 12,4
⇒ nCH3COOH = nNaOH = 12,4.10-3. 0,1 = 1,24.10-3 mol
⇒ mCH3COOH(1lít) = 1,24.10-3. 60. 100 = 7,44g
Bài 8: Phân biệt các dung dịch sau : (NH4)2SO4, NaNO3, NH4NO3, Na2CO3 bằng phương pháp hoá học với hoá chất duy nhất là
A. NaOH. B. Ba(OH)2 C, HCl, D. H2SO4
Đáp án: B
Bài 9: Có 4 dung dịch mất nhãn riêng biệt sau: NaOH, H2SO4, HCl, Na2CO3. Chỉ dùng thêm hoá chất nào sau đây để phân biệt 4 dung dịch trên
A. Dung dich BaCl2.
B. Dung dich phenolphtalein.
C. Dung dich NaHCO3.
D. Quy tím.
Đáp án: A
Bài 10: Thuốc thử nào dưới đây nhận biết được 3 dung dịch riêng biệt Na2CO3, MgCl2 va Al(NO3)3 (chỉ dùng một lần thử với mỗi dung dịch) ?
A. dung dịch NaOH. B. dung dịch HCl
C. dung dịch BaCl2. D, dung dịch H2SO4.
Đáp án: A
Bài 11: Có 6 chất rắn riêng biệt gồm CuO, FeO, Fe3O4, MnO2, Ag2O và hỗn hợp (Fe + FeO). Có thể dùng dung dịch chứa chất nào sau đây để phân biệt 6 chất rắn trên ?
A. H2SO4 đặc nguội B. HCl loãng, đun nóng
C. HNO3 loãng D, H2SO4 loãng
Đáp án: B
Thuốc thử cần dùng là dung dịch HCl loãng, đun nóng
CuO + HCl → dung dịch màu xanh dương
FeO + HCl → dung dịch màu xanh nhạt
Fe3O4 + HCl → dung dịch màu vàng
MnO2 + HCl → dung dịch màu vàng lục
Ag2O + HCl → chất rắn chuyển nâu đen sang trắng
(Fe + FeO ) + HCl → khí, dung dịch màu xanh nhạt
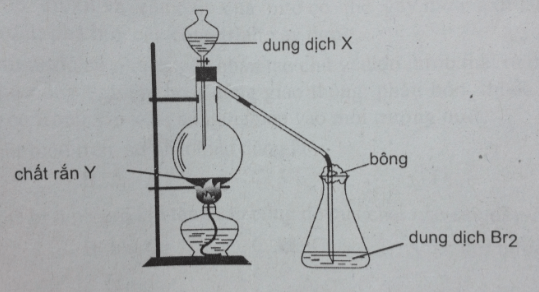
Bài 12: Cho sơ đồ mô tả thí nghiệm như hình vẽ :
Để dung dịch Br2 trong bình tam giác mất màu thì dung dịch X và chất rắn Y là
A, H2SO4 và NaNO3. B. H2SO4 và CaCO3.
C. H2SO4 và Na2SO3. D. H2SO4 và Ca3(PO4)2
Đáp án: C
Bài 13: Bằng phương pháp hóa học hãy phân biệt hai khí SO2 và CO2.
Lời giải:
Dẫn lần lượt từng khí qua ống nghiệm đựng dung dịch brom. Khí làm mất màu nâu đỏ của brom là SO2, không làm mất màu hay nhạt màu dung dịch brom là CO2.
SO2 + Br2 + H2O→ 2HBr + H2SO4.
Bài 14: Bằng phương pháp hóa học nào có thể nhận biết được hai khí không màu, không mùi là CO2 và O2 chứa trong 2 bình riêng biệt, mất nhãn.
Lời giải:
- Đánh số thứ tự từng bình mất nhãn.
- Đưa que đóm còn tàn đỏ lần lượt vào đầu ống dẫn khí của từng bình. Nếu que đóm bùng cháy thì bình chứa khí O2.
- Dẫn khí ở bình còn lại qua ống nghiệm đựng nước vôi trong, thấy xuất hiện kết tủa trắng → bình chứa CO2.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Bài 15: Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, KOH, Na2SO4, NaCl.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ: HCl
+ Quỳ tím chuyển sang màu xanh: KOH
+ Quỳ tím không đổi màu: Na2SO4, NaCl (nhóm I)
- Phân biệt nhóm I: Dùng BaCl2
+ Có kết tủa trắng: Na2SO4
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
+ Không hiện tượng: NaCl
Bài 16: Phân biệt các dung dịch sau: NaOH; HCl; BaCl2; H2SO4 chứa trong các lọ riêng biệt, mất nhãn.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím hóa xanh: NaOH
+ Quỳ tím không đổi màu: BaCl2
+ Quỳ tím hóa đỏ: HCl; H2SO4 (nhóm I)
- Phân biệt nhóm I: Sử dụng BaCl2
+ Xuất hiện kết tủa trắng: H2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+ Không hiện tượng: HCl
Bài 17: Không sử dụng quỳ tím, phân biệt các dung dịch sau chứa trong lọ mất nhãn bằng phương pháp hóa học: HCl, NaBr, MgF2.
Lời giải:
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ vào mỗi ống nghiệm một vài giọt AgNO3.
- Ống nghiệm nào có kết tủa trắng xuất hiện là ống nghiệm chứa HCl
HCl + AgNO3 → AgCl↓ + HNO3
- Ống nghiệm nào có kết tủa vàng xuất hiện là ống nghiệm chứa NaBr
NaBr + AgNO3 → AgBr↓ + NaNO3
- Ống nghiệm nào không có hiện tượng gì là ống nghiệm chứa MgF2.
Bài 18: Không sử dụng quỳ tím, chỉ dùng thêm một hóa chất hãy phân biệt các dung dịch sau chứa trong lọ mất nhãn bằng phương pháp hóa học: HCl, NaBr, BaCl2.
Lời giải:
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ lần lượt vào từng ống nghiệm một vài giọt Na2CO3.
+ Ống nghiệm nào có khí thoát ra là ống nghiệm chứa HCl
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
+ Ống nghiệm nào có kết tủa trắng xuất hiện là ống nghiệm chứa BaCl2.
BaCl2 + Na2CO3 → 2NaCl + BaCO3↓
+ Ống nghiệm nào không có hiện tượng xảy ra là ống nghiệm chứa NaBr.
Dán nhãn từng lọ vừa nhận biết.
Bài 19: Chỉ dùng thêm một hóa chất hãy nhận biết các lọ mất nhãn chứa các dung dịch sau: H2SO4; Na2SO4; Na2CO3; MgSO4 bằng phương pháp hóa học.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sau đó dùng thuốc thử là axit HCl nhỏ vào các mẫu thử.
Mẫu thử nào có khí thoát ra thì đó là Na2CO3 do có phản ứng:
Na2CO3 + 2HCl → NaCl + CO2 ↑ + H2O
- Sau đó dùng Na2CO3 vừa nhận ra nhỏ vào các mẫu thử còn lại,
+ Mẫu thử nào có khí thoát ra thì đó là H2SO4 do có phản ứng:
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2 ↑
+ Mẫu thử nào xuất hiện kết tủa trắng thì đó là MgSO4 do có phản ứng:
MgSO4 + Na2CO3→ Na2SO4 + MgCO3↓
- Mẫu thử còn lại không có hiện tượng gì chính là Na2SO4.
Bài 20: Bằng phương pháp hoá học hãy phân biệt 4 lọ mất nhãn chứa các dung dịch sau: NaOH, HCl, NaCl, NaNO3.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mẫu thử.
- Tiến hành phân biệt các chất theo bảng sau:
|
Mẫu thử Thuốc thử |
NaOH |
HCl |
NaCl |
NaNO3 |
|
Quỳ tím |
Xanh |
Đỏ |
- |
- |
|
AgNO3 |
|
↓ trắng |
- |
(chú ý: “ – ” là không xảy ra hiện tượng gì)
- Phương trình hóa học minh họa:
AgNO3 + NaCl → AgCl↓ + NaNO3.
Bài 21: Cho 4 lọ mất nhãn đựng các dung dịch NaCl, AlCl3, MgCl2, NaOH. Chỉ dùng thêm một hóa chất là phenolphtalein hãy trình bày cách phân biệt 4 lọ.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi mẫu thử một vài giọt phenolphtalein.
+ Dung dịch chuyển sang màu hồng → NaOH
+ 3 mẫu thử còn lại không có hiện tượng gì.
- Lần lượt cho từ từ NaOH (đã nhận ra ở trên) đến dư vào ba mẫu thử còn lại.
+ Xuất hiện kết tủa trắng, kết tủa không tan khi NaOH dư → mẫu thử là MgCl2.
PTHH: 2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
+ Xuất hiện kết tủa trắng, kết tủa tan khi NaOH dư → mẫu thử là AlCl3.
PTHH: 3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Mẫu thử còn lại không thấy hiện tượng gì thì đó là NaCl.
Bài 22: Không dùng thêm hoá chất nào khác hãy nhận biết 4 lọ hoá chất mất nhãn chứa các dung dịch sau: BaCl2, H2SO4, Na2CO3 và ZnCl2.
Lời giải:
Trích mỗi lọ ra làm các mẫu thử khác nhau rồi lần lượt cho mẫu thử này lần lượt phản ứng với các mẫu thử còn lại ta được kết quả cho bởi bảng sau:
|
|
BaCl2 |
H2SO4 |
Na2CO3 |
ZnCl2 |
|
BaCl2 |
|
BaSO4↓ |
BaCO3↓ |
- |
|
H2SO4 |
BaSO4↓ |
|
CO2 ↑ |
- |
|
Na2CO3 |
BaCO3↓ |
CO2 ↑ |
|
ZnCO3↓ |
|
ZnCl2 |
- |
- |
ZnCO3↓ |
|
{(-) không phản ứng hoặc không có hiện tượng gì}
Qua bảng ta nhận thấy:
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho 2 kết tủa thì mẫu thử đó là BaCl2.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho kết quả là 2 chất kết tủa và một chất khí là Na2CO3.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho là một chất kết tủa và một chất khí là H2SO4.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại mà chỉ cho một kết tủa thì đó là ZnCl2.
Các phương trình phản ứng:
ZnCl2 + Na2CO3 → 2NaCl + ZnCO3↓
BaCl2 +H2SO4 → BaSO4↓ + 2HCl
Na2CO3 + H2SO4 → NaSO4 + H2O + CO2 ↑
Na2CO3 + BaCl2 → 2NaCl + BaCO3↓.
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 Bài tập về Hợp kim của sắt (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất của kim loại (2024) có đáp án chi tiết nhất
30 Bài tập về Sự ăn mòn kim loại (2024) có đáp án chi tiết nhất
30 Bài tập về Vật liệu polime (2024) có đáp án chi tiết nhất
30 Bài tập về Đại cương về polime (2024) có đáp án chi tiết nhất