Phương trình Zn + O2 → ZnO
1. Phương trình phản ứng hóa học:
2Zn + O2 → 2ZnO
2. Cách thực hiện phản ứng
- Cho kẽm tác dụng với oxi
3. Hiện tượng nhận biết phản ứng
Kẽm cháy sáng trong không khí tạo muối màu trắng.
4. Điều kiện phản ứng
- Nhiệt độ
5. Tính chất hoá học
5.1. Tính chất hoá học của Kẽm
- Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
Tác dụng với phi kim
- Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
Tác dụng với H2O
- Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
Tác dụng với bazơ
- Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5.2. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
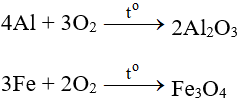
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
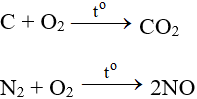
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
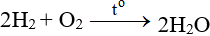
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
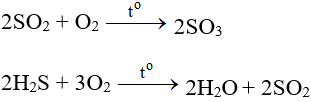
- Tác dụng với các chất hữu cơ:
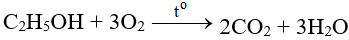
6. Bạn có biết
Kẽm là kim loại có tính khử mạnh nên dễ dàng tham gia phản ứng với các chất có tính oxi hóa mạnh như O2; Cl2 …
7. Bài tập liên quan
Bài 1: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
A. 11,2 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít.
Hướng dẫn giải:
Số mol Zn là: nZn=1365=0,2mol
PTHH: 2Zn + O2 to→ 2ZnO
Tỉ lệ theo PT: 2mol 1mol 2mol
0,2mol ? mol
Số mol khí O2 đã dùng là: nO2=0,2.12=0,1mol
=> Thể tích O2 là: V = n.22,4 = 0,1.22,4 = 2,24 lít
Đáp án cần chọn là: C
Bài 2: Đốt cháy hoàn toàn m gam hỗn hợp gồm Mg và Zn cần vừa đủ 2,8 lít khí O2 (đktc), thu được 9,1 gam hỗn hợp 2 oxit. Giá trị của m:
A. 3,9 g
B. 6,7 g
C. 7,1 g
D. 5,1 g
Đáp án D
Hướng dẫn giải:
nO2 = 0,125 mol; ⇒ mO2 = 32.0,125 = 4 gam;
Ta có: mX + mO2 = m(oxit) ⇒ mX = 9,1 - 4 = 5,1 gam.
Bài 3: Đốt cháy kim loại 3,25 g M trong oxi thu được oxit kim loại. Oxit kim loại tác dụng vừa đủ với 100ml dung dịch HCl 1 M. Kim loại M là:
A. Mg
B. Zn
C. Fe
D. Al
Đáp án B
Hướng dẫn giải:
Phương trình phản ứng: M + O2 → M2On
M2On + 2nHCl → 2MCln + nH2O
M = 3,25/(0,1/n) = 32,5 n ⇒ M là Zn
Bài 4: Đốt cháy m gam hỗn hợp kim loại Cu và Zn trong khí oxi dư thu được (m + 4,8) gam chất rắn X. Tổng số mol của hai kim loại là:
A. 0,1.
B. 0,3.
C. 0,6.
D. 0,5.
Hướng dẫn giải:
BTKL: mkim loại + moxi = mX ⟹ moxi = 4,8 ⟹ nO = 0,3 mol.
Gọi số mol Cu và Zn lần lượt là a, b
Cu0→ Cu2+ + 2e
a → 2a
Zn0→ Zn2+ + 2e
b → 2b
ne nhường = 2a + 2b.
O + 2e → O-2.
0,3→0,6
ne nhường = ne nhận⟹ 2a + 2b = 0,6 ⟹ a + b = 0,3
Đáp án B
Bài 5: Trong số các kim loại Al, Zn, Fe, Ag. Kim loại nào không tác dụng được với O2 ở nhiệt độ thường
A. Ag
B. Zn
C. Al
D. Fe
Hướng dẫn giải:
Đáp án A.
Bài 6: Đốt cháy hết m gam X gồm Mg, Al, Zn trong O2 dư ở nhiệt độ cao được 26,4 gam Y gồm các oxit kim loại. Hoà tan hết m gam X trong dung dịch H2SO4 dư được 8,96 lít H2 đktc .Tìm m:
A. 23,2g
В. 20g
C. 18,4g
D. 21,6g
Hướng dẫn giải:
Đáp án: B
nH2=8,9622,4=0,4(mol)
Ở cả 2 thí nghiệm, kim loại đều nhường e với số mol như nhau do cùng tăng số oxi hoá giống nhau ở 2 thí nghiệm.
Bảo toàn e:
4nO2=2nH2
⇒nO2=0,2(mol)
BTKL: m=26,4−0,2.32=20g
Xem thêm các phương trình hóa học liên quan khác:
Zn + HNO3 (đặc) → Zn(NO3)2 + NO2 + H2O | Zn ra Zn(NO3)2
Zn + HNO3 loãng → Zn(NO3)2 + NH4NO3 + H2O | Zn + HNO3 ra NH4NO3
Zn ra ZnSO4 | Zn + CuSO4 → ZnSO4 + Cu




