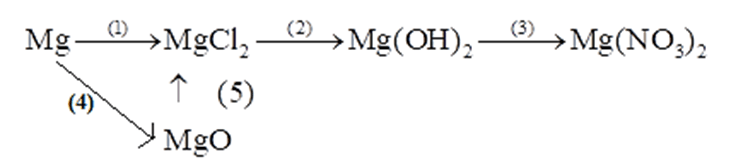Giải VBT KHTN 8 Bài 12: Muối
I. Khái niệm muối trang 60 Vở bài tập KHTN 8:
|
……………………………………………… ……………………………………………… …………………………………………… …………………………………………… |
Lời giải:
|
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+). Ví dụ: NaCl, K2SO4, Ca3(PO4)2, NH4NO3 … |
CH trang 61 Vở bài tập KHTN 8:
|
Muối |
Na3PO4 |
MgCl2 |
CaCO3 |
CuSO4 |
KNO3 |
|
Acid tương ứng |
Lời giải:
|
Muối |
Na3PO4 |
MgCl2 |
CaCO3 |
CuSO4 |
KNO3 |
|
Acid tương ứng |
H3PO4 |
HCl |
H2CO3 |
H2SO4 |
HNO3 |
LT1 trang 61 Vở bài tập KHTN 8:
Tên gọi của các muối là:
KCl: ……………………………………………………………………………………
ZnSO4: ………………………………………………………………………………….
MgCO3: …………………………………………………………………………………
Ca3(PO4)2: ………………………………………………………………………………
Cu(NO3)2: ………………………………………………………………………………
Al2(SO4)3: ………………………………………………………………………………
Lời giải:
KCl: Potassium chloride
ZnSO4: Zinc sulfate
MgCO3: Magnesium carbonate
Ca3(PO4)2: Calcium phosphate
Cu(NO3)2: Copper(II) nitrate
Al2(SO4)3: Aluminium sulfate.
III. Tính tan của muối trang 61 Vở bài tập KHTN 8:
|
……………………………………………… ……………………………………………… ……………………………………………… …………………………………………… |
Lời giải:
|
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, … - Có muối ít tan trong nước như: CaSO4, PbCl2, … - Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, … |
LT2 trang 61 Vở bài tập KHTN 8:
Những muối tan được trong nước là
………………………………………………………………………………………
Lời giải:
Những muối tan được trong nước là: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, MgSO4.
TH1 trang 61 Vở bài tập KHTN 8:
Hiện tượng xảy ra: ……………………………………………………………………..
Bề mặt sợi dây đồng: ………………………………………………………………….
Màu của dung dịch trong ống nghiệm: ………………………………………………..
Giải thích: ……………………………………………………………………………..
|
……………………………… ……………………………… ……………………………… ……………………………… |
Lời giải:
Hiện tượng xảy ra: Mẩu dây đồng tan dần, có lớp kim loại trắng bạc bám ngoài dây đồng, dung dịch sau phản ứng có màu xanh.
Bề mặt sợi dây đồng: có lớp kim loại trắng bạc.
Màu của dung dịch trong ống nghiệm: màu xanh.
Giải thích: Do dung dịch AgNO3 đã phản ứng với kim loại Cu theo phương trình hoá học sau: 2AgNO3 + Cu → Cu(NO3)2 + 2Ag↓.
|
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới. Ví dụ: 2AgNO3 + Cu → Cu(NO3)2 + 2Ag Fe(NO3)2 + Cu → Cu(NO3)2 + Fe |
LT3 trang 62 Vở bài tập KHTN 8: Phương trình hoá học của phản ứng xảy ra khi ngâm Zn trong dung dịch CuSO4 là ………………………………………………
Dự đoán sự thay đổi màu của dung dịch ………………………………………….
Lời giải:
Phương trình hoá học của phản ứng xảy ra khi ngâm Zn trong dung dịch CuSO4 là:
Zn + CuSO4 → ZnSO4 + Cu.
Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
LT4 trang 62 Vở bài tập KHTN 8:
a) Phương trình hoá học của phản ứng xảy ra khi cho Fe vào dung dịch CuSO4 là
……………………………………………………………………………..
b) Phương trình hoá học của phản ứng xảy ra khi cho Zn vào dung dịch AgNO3 là
……………………………………………………………………………..
Lời giải:
a) Fe + CuSO4 → FeSO4 + Cu.
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
TH2 trang 62 Vở bài tập KHTN 8:
Hiện tượng xảy ra: …………………………………………………………………….
Giải thích: ……………………………………………………………………………..
|
………………………………………… ………………………………………… ………………………………………… |
Lời giải:
Hiện tượng xảy ra: Xuất hiện kết tủa trắng.
Giải thích: Dung dịch BaCl2 phản ứng với dung dịch H2SO4 tạo thành kết tủa trắng là BaSO4. Phương trình hoá học:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
|
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới. Ví dụ: BaCl2 + H2SO4 → BaSO4↓ + 2HCl CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O |
LT5 trang 63 Vở bài tập KHTN 8:
a) Dự đoán hiện tượng xảy ra khi nhỏ dung dịch H2SO4 loãng vào dung dịch Na2CO3: …………………………………………………………………………………….
Giải thích: …………………………………………………………………………
Phương trình hoá học của phản ứng xảy ra: ………………………………………
b) Dự đoán hiện tượng xảy ra khi nhỏ dung dịch HCl loãng vào dung dịch AgNO3: …………………………………………………………………………………….
Giải thích: …………………………………………………………………………
Phương trình hoá học của phản ứng xảy ra: ………………………………………
Lời giải:
a) Dự đoán hiện tượng xảy ra khi nhỏ dung dịch H2SO4 loãng vào dung dịch Na2CO3: có khí thoát ra.
Giải thích: H2SO4 loãng tác dụng với Na2CO3 sinh ra khí CO2.
Phương trình hoá học của phản ứng xảy ra: H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O.
b) Dự đoán hiện tượng xảy ra khi nhỏ dung dịch HCl loãng vào dung dịch AgNO3: xuất hiện kết tủa trắng.
Giải thích: HCl tác dụng với AgNO3 sinh ra kết tủa trắng
Phương trình hoá học của phản ứng xảy ra: HCl + AgNO3 → AgCl↓ + HNO3.
TH3 trang 63 Vở bài tập KHTN 8:
Hiện tượng xảy ra: …………………………………………………………………….
Giải thích: ……………………………………………………………………………..
|
…………………………………… …………………………………… …………………………………… |
Lời giải:
- Hiện tượng xảy ra: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
- Giải thích: CuSO4 tác dụng với NaOH sinh ra kết tủa Cu(OH)2 có màu xanh. Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
|
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới. Ví dụ: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl |
LT6 trang 64 Vở bài tập KHTN 8:
a) Phương trình hoá học của phản ứng xảy ra khi cho dung dịch FeCl3 tác dụng với dung dịch NaOH……………………………………………………………………………….
b) Phương trình hoá học của phản ứng xảy ra khi cho dung dịch CuCl2 tác dụng với dung dịch KOH…………………………………………………………………………
Lời giải:
a) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
b) CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl.
LT7 trang 64 Vở bài tập KHTN 8:
a) …………………………………………………………………………
b) …………………………………………………………………………
Lời giải:
a) MgO + H2SO4 → MgSO4 + H2O
b) 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl.
TH4 trang 64 Vở bài tập KHTN 8:
Hiện tượng xảy ra: …………………………………………………………………….
Giải thích: ……………………………………………………………………………..
|
………………………………………………… …………………………………………………… ……………………………………………………… …………………………………………………… |
Lời giải:
- Hiện tượng xảy ra: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch Na2CO3 tác dụng với dung dịch CaCl2 sinh ra kết tủa trắng là CaCO3 theo phương trình hoá học:
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl.
|
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới. Ví dụ: CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl Na2SO4 + BaCl2 → 2NaCl + BaSO4↓ |
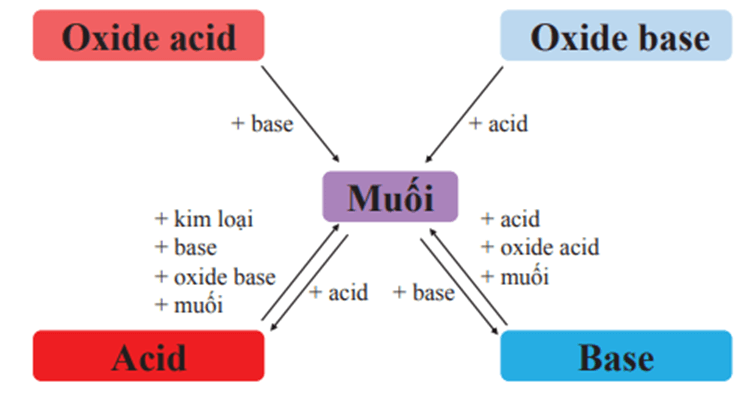
Sơ đồ mối quan hệ giữa acid, base, oxide và muối trang 64 Vở bài tập KHTN 8:
Lời giải:
LT8 trang 65 Vở bài tập KHTN 8:
a) Phương trình hoá học của phản ứng xảy ra khi cho dung dịch NaCl tác dụng với dung dịch AgNO3: ………………………………………………………………………….
b) Phương trình hoá học của phản ứng xảy ra khi cho dung dịch Na2SO4 tác dụng với dung dịch BaCl2: ………………………………………………………………………
c) Phương trình hoá học của phản ứng xảy ra khi cho dung dịch K2CO3 tác dụng với dung dịch Ca(NO3)2…………………………………………………………………….
Lời giải:
a) NaCl + AgNO3 → AgCl↓ + NaNO3.
b) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl.
c) K2CO3 + Ca(NO3)2 → CaCO3↓ + 2KNO3.
LT9 trang 65 Vở bài tập KHTN 8: Các phương trình hoá học theo sơ đồ chuyển hoá:
(1) …………………………………………………………………….
(2) …………………………………………………………………….
(3) …………………………………………………………………….
Lời giải:
(1) CuO + H2SO4 → CuSO4 + H2O.
(2) CuSO4 + BaCl2 → BaSO4↓ + CuCl2.
(3) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
LT10 trang 66 Vở bài tập KHTN 8: Ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH:
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
Lời giải:
Ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH:
(1) 2NaOH + SO3 → Na2SO4 + H2O.
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O.
(3) 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
LT11 trang 66 Vở bài tập KHTN 8: Ba phương trình hoá học khác nhau để điều chế CuCl2:
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
Lời giải:
Ba phương trình hoá học khác nhau để điều chế CuCl2:
(1) CuO + 2HCl → CuCl2 + H2O.
(2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O.
(3) CuSO4 + BaCl2 → CuCl2 + BaSO4↓.
VD trang 66 Vở bài tập KHTN 8:
……………………………………………………………………………………………
…………………………………………………………………………………………..
…………………………………………………………………………………………..
Lời giải:
Đổi 51 kg = 51 000 gam.
Phương trình hoá học: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Theo phương trình hoá học có:
Khối lượng Al2(SO4)3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171 000 gam = 171 kg.
Ghi nhớ trang 66 Vở bài tập KHTN 8:
|
Ghi nhớ: …………………………………… …………………………………… …………………………………… |
Lời giải:
|
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+). - Muối tác dụng được với kim loại, dung dịch acid, dung dịch base, dung dịch muối. - Muối có thể được tạo ra bằng cách cho dung dịch acid tác dụng với: base, oxide base, muối hoặc cho hai dung dịch muối tác dụng với nhau … - Acid, base và oxide có các tính chất hoá học sau: + Dung dịch acid: làm quỳ tím chuyển sang màu đỏ, tác dụng với kim loại, base, oxide base, muối. + Dung dịch base: làm quỳ tím chuyển sang màu xanh, tác dụng với dung dịch acid, oxide acid, dung dịch muối. + Oxide base tác dụng với dung dịch acid, oxide acid tác dụng với dung dịch base. |
Bài tập 1 trang 67 Vở bài tập KHTN 8: Hoàn thành các phương trình hoá học theo sơ đồ chuyển hoá sau:
Lời giải:
(1) Mg + 2HCl → MgCl2 + H2
(2) MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
(3) Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
(4) 2Mg + O2 → 2MgO
(5) MgO + 2HCl → MgCl2 + H2O
Bài tập 2 trang 67 Vở bài tập KHTN 8: Muối MgSO4 chủ yếu được sử dụng làm phân bón, ngoài ra còn được dùng làm chất hút mồ hôi tay của các vận động viên. Tính khối lượng MgSO4 tạo thành khi cho 80 kg MgO tác dụng hết với dung dịch H2SO4.
Lời giải:
Đổi 80 kg = 80 000 gam.
Phương trình hoá học: MgO + H2SO4 → MgSO4 + H2O
Theo phương trình hoá học ta có:
Bài tập 3 trang 67 Vở bài tập KHTN 8: Đề xuất cách phân biệt các dung dịch không màu sau: dung dịch hydrochloric acid, dung dịch sodium hydroxide, dung dịch sodium chloride và dung dịch sodium sulfate.
Lời giải:
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → dung dịch hydrochloric acid (HCl).
+ Quỳ tím chuyển sang màu xanh → dung dịch sodium hydroxide (NaOH).
+ Quỳ tím không đổi màu: dung dịch sodium chloride (NaCl) và dung dịch sodium sulfate (Na2SO4).
- Sử dụng dung dịch BaCl2 để phân biệt NaCl và Na2SO4:
+ Có kết tủa trắng → Na2SO4:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
+ Không có hiện tượng → NaCl.
Xem thêm các bài giải VTH Khoa học tự nhiên 8 Cánh diều hay, chi tiết khác: