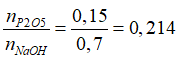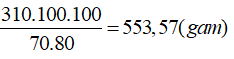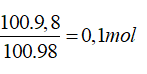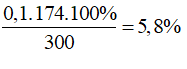Phản ứng P2O5 + KOH → K3PO4 + H2O
1. Viết phương trình phản ứng P2O5 tác dụng KOH
P2O5+ 6KOH → 2K3PO4 + 3H2O
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của P2O5 (Điphotpho pentaoxit)
P2O5 là một oxit axit mang đầy đủ tính chất hoá học của một oxit axit nên tác dụng được với dung dịch kiềm tạo thành muối.
3.2. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh tác dụng được với các oxit axit ở điều kiện nhiệt độ phòng.
4. Dạng bài tập P2O5 tác dụng với dung dịch NaOH hoặc KOH
Thực chất là axit H3PO4 (do P2O5 + H2O trong dung dịch KOH) tác dụng với KOH có thể xảy ra các phản ứng sau :
H3PO4 + KOH → KH2PO4 + H2O (1)
H3PO4 + 2KOH → K2HPO4 + 2H2O (2)
H3PO4+ 3KOH → K3PO4 + 3H2O (3)
Giả sử có dung dịch chứa a mol H3PO4 tác dụng với dung dịch có chứa b mol KOH thu được dung dịch A ta có thể biện luận các chất theo tương quan giữa a và b như sau :
(1) Nếu 0 < b/a <1 chỉ xảy ra phản ứng (1) taọ ra KH2PO4và H3PO4 còn dư
(2) Nếu b/a = 1 phản ứng (1) vừa đủ tạo ra KH2PO4
(3) Nếu Nếu 1 < b/a <2 xảy ra cả phản ứng(1) và phản ứng (2) taọ ra KH2PO4 và K2HPO4
(4) Nếu b/a = 2 phản ứng (2) vừa đủ tạo ra K2HPO4
(5) Nếu Nếu 2 < b/a <3 xảy ra cả phản ứng (2) và phản ứng (3) taọ ra K3PO4 và K2HPO4
(6) Nếu b/a = 3 phản ứng (3) vừa đủ tạo ra K3PO4
(7) Nếu b/a > 3 chỉ xảy ra phản ứng (3) tạo ra K3PO4 và KOH còn dư
5. Câu hỏi vận dụng
Câu 1. Cho 15,62 gam P2O5 vào 400 ml dung dịch NaOH nồng độ a M thu được dung dịch có tổng khối lượng các chất tan bằng 24,2 gam. Giá trị của a là:
A. 0,2
B.0,3
C. 0,4
D. 0,5
Lời giải:
Đáp án: B
P2O5+ 3H2O → 2H3PO4
0,11 0,22mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Nếu chất tan trong dung dịch chỉ chứa các muối thì:
Theo các PT ta có: nH2O= nNaOH= 0,4a (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O →0,4a. 40 + 0,22.98= 24,2 + 0,4a.18 → a= 0,3 M
Câu 2. Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
A. 0,214
B. 0,286
C. 0,429
D. 0,143
Lời giải:
Đáp án: A
P2O5+ 3H2O → 2 H3PO4
m/142 2m/142 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O= nNaOH= 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O → 0,7.40 + (2m/142).98=2,1033m + 0,7.18 →m = 21,3 gam
→nP2O5= 0,15 mol →
Câu 3. Đun nóng hỗn hợp Ca và P đỏ. Hoà tan sản phẩm thu được vào dd HCl dư thu được 28lít khí ở đktc. Đốt cháy khí này thành P2O5. Lượng oxit thu được tác dụng với dung dịch kiềm tạo thành 142g Na2HPO4. Xác định thành phần % về khối lượng mỗi chất trong hỗn hợp đầu.
A. 69,31%; 30,69%
B. 35,57%; 64,43%
C. 30%; 70%
D. 40%; 60%
Lời giải:
Đáp án: A
Ta có nkhí= 1,25 mol; nNa2HPO4= 1 mol
3Ca + 2P → Ca3P2 (1)
Sản phẩm thu được có chứa Ca3P2, có thể có Ca dư hoặc P dư
Ca3P2+ 6HCl→ 3CaCl2+ 2PH3↑ (2)
Ca + 2HCl → CaCl2+ H2 ↑ (3)
2PH3+ 4O2 → P2O5+ 3H2O (4)
1 ← 0,5 mol
P2O5+ 4NaOH → 2Na2HPO4+ H2O (5)
0,5 ← 1 mol
Theo PT (2), (4), (5) ta thấy nPH3= nNa2HPO4= 1 mol ⟨1,25 mol → Sản phẩm khí phải có H2
→ nH2= 1,25- 1 = 0,25 mol→ nCa dư= nH2= 0,25 mol
Theo PT (2): nCa3P2= 0,5. nPH3= 0,5 mol
Theo PT (1): nCa pứ= 3.nCa3P2= 1,5 mol; nP pứ= 2.nCa3P2= 2.0,5= 1 mol
nCa banđầu= nCa pứ + nCa dư= 0,25 + 1,5= 1,75 mol
→Trong hỗn hợp đầu có: mCa= 1,75.40= 70 gam; mP= 1.31= 31 gam
→%mCa= 69,31%; %mP= 30,69%
Câu 4. Tiến hành nung một loại quặng chứa Ca3(PO4)2 hàm lượng 70% với C và SiO2 đều lấy dư ở 10000C. Tính lượng quặng cần lấy để có thể thu được 62 g P. Biết hiệu suất phản ứng đạt 80%.
A. 484,375 gam
B. 553,6 gam
C. 310 gam
D. 198,4 gam
Lời giải:
Đáp án: B
Ca3(PO4)2+ 3SiO2+ 5C → 3 CaSiO3+ 2P + 5 CO
Ta có nCa3(PO4)2= 0,5. nP= 0,5. 2= 1,0 mol → mCa3(PO4)2= 1. 310= 310 (gam)
→ Khối lượng quặng cần lấy là:
mquặng=
Câu 5. Tính lượng P cần dùng để có thể điều chế được 100 ml dung dịch H3PO4 31,36% (d = 1,25 gam/ml). Biết hiệu suất phản ứng đạt 100%.
A. 3,1 gam
B. 6,2 gam
C. 9,3 gam
D. 12,4 gam
Lời giải:
Đáp án: D
Khối lượng dung dịch H3PO4 là mdung dịch= V. D=100. 1,25= 125 gam
→ mH3PO4= 125.31,36/100= 39,2 gam → nH3PO4= 0,4 mol
Bảo toàn nguyên tố P ta có: nP= nH3PO4= 0,4 mol → mP= 12,4 gam
Câu 6. Lấy V(ml) dung dịch H3PO435% ( d = 1,25gam/ml ) đem trộn với 100 ml dung dịch KOH 2M thu được dung dịch X có chứa 14,95 gam hỗn hợp 2 muối K3PO4và K2HPO4. Tính V?
A. 15,12 ml
B. 16,8 ml
C. 18,48 ml
D. 18,6 ml.
Lời giải:
Đáp án: B
H3 PO4 + 2KOH → K2HPO4+ 2H2O
x 2x x mol
H3PO4 + 3KOH → K3PO4 + 3H2O
y 3y y mol
Ta có: nKOH= 2x + 3y= 0,1.2= 0,2 mol
mhỗn hợp muối= 174x + 212 y= 14,95 gam
Giải hệ trên ta có: x= 0,025 mol; y = 0,05 mol → nH3PO4= x+y= 0,075 mol
→ mH3PO4= 0,075. 98= 7,35 gam →mdung dịch H3PO4 35%= 7,35.100/35= 21 (gam)
→Vdd = m/D= 21/1,25= 16,8 ml
Câu 7. Trộn lẫn 200 gam dung dịch K2HPO417,4% với 100 gam dung dịch H3PO49,8%. Tính nồng độ % của 2 muối photphat trong dung dịch thu được ?
A. 9,07%; 5,8%
B. 9,07%; 6,2%
C. 8,07%; 5,8%
D. 8,07%; 6,2%
Lời giải:
Đáp án: A
Ta có: nK2HPO4= 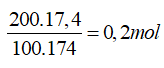
K2HPO4+ H3PO4 → 2KH2PO4
0,2 0,1 0,2 mol
Ta có: 0,2 >0,1 nên K2HPO4 dư
Ta có dung dịch thu được có chứa 0,2 mol KH2PO4 và 0,1 mol K2HPO4 dư
Ta có: mdung dịch= 200 + 100= 300 gam
C%KH2PO4 = 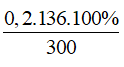
Câu 8. Khối lượng quặng photphorit chứa 65% Ca3(PO4)2cần lấy để điều chế 150 kg photpho là (có 3% P hao hụt trong quá trình sản xuất).
A. 1,189 tấn
B. 0,2 tấn
C. 0,5 tấn
D. 2,27 tấn
Lời giải:
Đáp án: A
Ta có sơ đồ: Ca3(PO4)2 → 2P
Ta có: nCa3(PO4)2= 0,5.nP= 0,5.150/31= 75/31 (kmol) → mCa3(PO4)2= (75/31).310= 750 (kg)
→ Khối lượng Ca3(PO4)2 thực tế cần có: 750.100/97=773,2 kg
→Khối lượng quặng photphoric cần lấy là: 773,2.100/65= 1189 kg= 1,189 tấn
Xem thêm các phương trình hóa học khác:
KOH + CO2 → KHCO3 l KOH ra KHCO3
KOH + HCl → KCl + H2O | KOH ra KCl
KOH + H3PO4 → K3PO4 + H2O | KOH ra K3PO4
P + KClO3 → KCl + P2O5 | P ra P2O5
KOH + H3PO4 → K3PO4 + H2O | KOH ra K3PO4