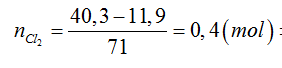Phản ứng NH4Cl + NaOH → NH3↑ + H2O + NaCl
1. Phương trình phản ứng NH4Cl ra NH3
NH4Cl + NaOH → NH3 + H2O + NaCl
2. Phương trình ion rút gọn NH4Cl cộng NaOH
NH4+ + OH− → NH3 + H2O
3. Điều kiện NH4Cl tác dụng với NaOH
Cho NH4Cl tác dụng với dung dịch NaOH, điều kiện: Nhiệt độ
4. Hiện tượng phản ứng khi cho NH4Cl tác dụng với NaOH
Khi cho NH4Cl tác dụng với dung dịch NaOH, xuất hiện bọt khí có mùi khai do khí Amoniac (NH3) sinh ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của NH4Cl (Amoni clorua)
Amoni clorua là muối của axit yếu nên có khả năng phản ứng với bazo mạnh như NaOH để giải phóng khí amoniac.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng với muối NH4Cl khi đun nóng và có khí mùi khai bay ra.
6. Mở rộng kiến thức liên quan muối amoni
Muối amoni là chất tinh thể ion, gồm cation amoni NH4+ và anion gốc axit.
Thí dụ: NH4Cl (amoni clorua),....
6.1. Tính chất vật lí
Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn tạo thành các ion.
6.2. Tính chất hóa học
a. Tác dụng với dung dịch kiềm
Dung dịch đậm đặc muối amoni + dung dịch kiềm → khí amoniac
Thí dụ
NH4Cl + NaOH NH3 + NaCl + H2O
=> Đây là phản ứng nhận biết ion amoni.
b. Phản ứng nhiệt phân
Muối amoni chứa gốc axit không có tính oxi hóa.
Thí dụ
(NH4)2CO3 2NH3 + CO2 + H2O
Muối amoni chứa gốc của axit có tính oxi hóa.
Thí dụ
NH4NO2 N + 2H2O
NH4NO3 N2O + 2H2O
7. Bài tập vận dụng liên quan
Câu 1. Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3.
B. Na2CO3.
C. NH4HCO3
D. NH4Cl
Lời giải:
Câu 2. Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
A. 3,0M.
B. 1,0M.
C. 2,0M.
D. 2,5M.
Lời giải:
Phương trình ion thu gọn
NH4+ + OH−→ NH3+ H2O
Theo phương trình hóa học: nOH- = nNH3= 5,622,4 = 0,25 mol
=> CM = nV = 0,250,1 = 2,5M
Câu 3. Thí nghiệm nào dưới đây không xảy ra phản ứng
A. Cho dung dịch NaOH vào dung dịch NH4Cl đun nóng.
B. Cho Fe vào dung dịch HNO3 đặc nguội.
C. Cho dung dịch NH3 vào dung dịch AlCl3 dư.
D. Cho kim loại Mg vào dung dịch HCl loãng.
Lời giải:
A. Cho dung dịch NaOH vào dung dịch NH4Cl đun nóng có khí mùi khai sinh ra
NaOH + NH4Cl → NaCl + NH3 + H2O
B. Fe bị thụ động trong dung dịch HNO3 đặc nguội.
C. Cho dung dịch NH3 vào dung dịch AlCl3 dư.
AlCl3 + 3NH3+ 3H2O → Al(OH)3↓(keo trắng) + NH4Cl
(NH3 có tính kiềm yếu nên không thể hòa tan Al(OH)3)
D. Cho kim loại Mg vào dung dịch HCl loãng có khí không màu thoát ra
Mg + 2HCl → MgCl2 + H2
Câu 4. Phản ứng nào sau đây có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O:
A. NH4Cl + NaOH → NaCl + NH3 + H2O
B. NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O
C. NaHCO3+ NaOH → Na2CO3 + H2O
D. Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Lời giải:
A. NH4Cl + NaOH → NaCl + NH3 + H2O
NH4+ + OH- → NH3 + H2O
B. NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O
NH4+ HCO3- + 2OH- → CO32- + NH3 + H2O
C. NaHCO3 + NaOH → Na2CO3 + H2O
HCO3‑ + OH‑ → CO32- + H2O
D. Ba(HCO3)2+ 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Ba2+ + HCO3- + 2OH- → BaCO3↓ + CO32- + 2H2O
Câu 5. Cho các dung dịch sau: NH4Cl, K2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
A. Dung dịch KCl.
B. Dung dịch KOH.
C. Dung dịch phenolphtalein
D. Dung dịch Ba(OH)2.
Lời giải:
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch KOH để nhận biết 3 muối trên
Xuất hiện khí có mùi khai thoát ra là NH4Cl
NH4Cl + KOH → NH3 + H2O + KCl
Xuất hiện kết tủa trắng Ba(HCO3)2
Ba(HCO3)2 + 2KOH → BaCO3 + K2CO3 + 2H2O
Không có hiện tượng gì là Na2SO4
Câu 6. Dẫn 4,48 lít NH3 (đktc) đi qua ống đựng 64 gam CuO nung nóng thu được chất rắn X và khí Y. Ngâm chất rắn X trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng? Coi hiệu suất quá trình phản ứng là 100%.
A. 0,5 lít.
B. 0,25 lít
C. 1 lít
D. 0,75 lít
Lời giải:
nNH3 = 4,4822,4 = 0,2 mol,
nCuO= 0,8 mol.
Phương trình phản ứng
2NH3 + 3CuO 3Cu + N2 + 3H2O (1)
mol: 0,1 0,8 → 0,3
=> nCuO dư = 0,8 - 0,3 = 0,5 mol
X gồm Cu (0,3 mol) và CuO dư (0,5 mol)
Phản ứng của X với dung dịch HCl :
CuO + 2HCl → CuCl2 + H2O (2)
mol: 0,5 → 1
Theo (2) và giả thiết ta suy ra:
VHCl= 12= 0,5 lít.
Câu 7. Hiện tượng nào xảy ra khi dẫn khí NH3 đi qua ống đựng bột CuO nung nóng
A. Bột CuO từ màu đen sang màu trắng.
B. Bột CuO từ màu đen sang màu đỏ, có hơi nước ngưng tụ.
C. Bột CuO từ màu đen sang màu xanh, có hơi nước ngưng tụ.
D. Bột CuO không thay đổi màu.
Lời giải:
Khi dẫn khí NH3 đi qua ống đựng bột CuO đun nóng thì chất rắn chuyển từ màu đen của CuO sang màu đỏ của Cu
NH3 + CuO → N2 + Cu + H2O
Câu 8. Cho 11,95 gam hỗn hợp R gồm NH4Cl và (NH4)2SO4 tác dụng hết với xút, đun nóng thu được 4,48 lít khí (đkc). Tính % khối lượng mỗi chất trong dung dịch R lần lượt là:
A. 44,77% và 55,23%
B. 55,23% và 44,77%
C. 40% và 60%
D. 60% và 40%
Lời giải:
Phương trình phản ứng:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
(NH4)2SO4+ 2NaOH → 2NH3↑ + Na2SO4 + H2O
Gọi x, y lần lượt là số mol của NH4Cl và (NH4)2SO4
Theo đề bài ta có:
53,5x + 132y = 11,95 (1);
x + 2y = 0,2 (2)
Từ 1, 2 ta có; x = 0,1 và y = 0,05.
%mNH4Cl = 0,1.53,523,9 = 44,77%
⇒ %m(NH4)2SO4 = 100% - 44,77% = 55,23 %
Câu 9. Cho dung dịch NH4NO3 tác dụng với dung dịch bazơ của kim loạithu được 4,48 lít khí (đktc) và 26,1 gam muối. Kim loại đó là
A. Ca
B. Mg
C. Cu
D. Ba
Lời giải:
Phương trình phản ứng tổng quát
nNH4NO3 + M(OH)n→ M(NO3)n + nNH3 + nH2O
0,2n 0,2
=> Mmuối = M+ 62n= 26,10,2xn
=> M = 68,5n => n = 2 và M là Bari.
Câu 10. Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối. Thể tích khí clo (đktc) đã tham gia phản ứng là
A. 6,72 lít.
B. 13,44 lít.
C. 4,48 lít.
D. 2,24 lít.
Lời giải:
Đáp án: A
nFeCl3 = 32,5/162,5 = 0,2 (mol)
Bảo toàn nguyên tố Cl
2nCl2 = 3nFeCl3 ⇒ nCl2 = 0,3 (mol) ⇒ V = 0,3 .22,4 = 6,72 (l)
Câu 11. Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 17,92 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 11,20 lít.
Lời giải:
Đáp án: C
Bảo toàn khối lượng:
⇒ V = 0,4 . 22,4 = 8,96l
Xem thêm các phương trình hóa học khác:
NH4Cl + AgNO3 → NH4NO3 + AgCl | NH4Cl ra NH4NO3
NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl | NH3 ra NH4Cl
NH3 + CuO → Cu + N2 + H2O | NH3 ra N2